养殖鱼类由于摄入营养成分不均衡或摄入能量过多而引发鱼体腹脂过度蓄积, 进而造成鱼体肠道炎症反应、代谢紊乱、应激及免疫力下降等问题已引起广泛关注。其中, 肠道微生态的紊乱是主要因素之一。动物肠道内定植着数量庞大的微生物菌群, 形成了一个特殊的微生态系统, 影响着宿主的生长与健康。从动物出生开始, 肠道菌群的形成就依赖于宿主基因、营养物质、生活方式及周围环境, 与宿主协同进化发展, 二者之间形成了一种互利共生的关系[1]。宿主为肠道菌群提供适宜的内部生存环境, 在肠道内选择性接受某些微生物的定植, 而肠道菌群则通过发酵食物中一些难以消化、吸收的营养物质, 产生如短链脂肪酸(short-chain fatty acids, SCFAs)等代谢产物[2], 并合成多种氨基酸和维生素等, 用于补充机体生长所需的营养物质[3]。
在过去几十年里, 大量关于哺乳动物消化道菌群的研究帮助我们深刻理解和认识了消化道微生物的结构组成和功能。与鱼类相关的微生物群落研究最早始于上世纪20年代[4], 随后大量关于鱼类肠道菌群的研究相继展开。鱼类是脊椎动物中种类最丰富的物种, 且生活环境及习性各不相同。目前, 与消化道菌群相关研究涉及的鱼类主要包括虹鳟(Oncorhynchus mykiss)、鲤(Cyprinus carpio)、大西洋鳕(Gadus morhua)、大西洋鲑(Salmo salar)、北极红点鲑(Salvelinus alpinus)、草鱼(Ctenopharyngodon idellus)、大菱鲆(Scophthalmus maximus)、斑点叉尾鮰(Ictalurus punctatus)和斑马鱼(Danio rerio)等, 并且随着测序技术的发展, 鱼类肠道菌群研究已成为了一个开拓性的热点研究领域[5-6]。但是, 鱼类上关于消化道菌群结构、功能及与机体代谢之间关系的研究尚不深入。为更好地了解和明确鱼类肠道菌群与脂代谢之间的关系及相互作用, 本文将结合近年来相关研究报道进行综述, 并从改善肠道微生态的角度提出相应策略, 为实际生产和应用提供一定的理论指导。
1 鱼类肠道菌群的组成与陆生脊椎动物相比, 鱼类胃肠道内主要定植着好氧型、兼性厌氧型和专性厌氧型细菌[1]。研究表明, 每克鱼类肠道内容物中含107~1011个细菌[7]。在第二代测序技术(next generation sequencing, NGS)的帮助下, 研究者发现鱼类消化道中占主导地位的为变形菌门(Proteobacteria), 拟杆菌门(Bacteroidetes), 放线菌门(Actinobacteria), 厚壁菌门(Firmicutes)和梭杆菌门(Fusobacterium)[6]。但是, 鱼类肠道菌群的组成结构会因物种、环境条件、饮食及养殖方式的不同而有所区别, 比如在海水鱼类肠道中, 兼性厌氧菌, 包括弧菌属(Vibrio)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、棒状杆菌属(Corynebacterium)、交替单胞菌属(Alteromonas)、黄杆菌属(Flavobacterium)和微球菌属(Micrococcus)[8-9]为主要类群, 而淡水鱼肠道中则主要为气单胞菌属(Aeromonas)、假单胞菌属(Pseudomonas)和拟杆菌属A型(Bacteroides type A), 邻单胞菌属(Plesiomonas)、肠杆菌属(Enterobacteriaceae)、微球菌属(Micrococcus)、不动杆菌属(Acinetobacter)、梭菌属(Clostridium)、拟杆菌属B型(Bacteroides type B)和镰刀菌属(Fusarium)则占较小比例[10-11]。总的来看, 不同地点、不同群体、相同或不同种鱼类的肠道菌群中有一些相似的细菌类群存在, 并且这些类群对宿主肠道功能及机体的新陈代谢发挥着极其重要的作用, 如消化、营养吸收和免疫反应等, 这类菌群常被称为“核心菌群”(core gut microbiota)[12]。
2 脂类营养对鱼类肠道菌群的影响脂类是微生物和鱼类等动物所必需的一种营养素[13], 同时作为机体的一种主要能源物质, 在组成细胞结构、调控信号因子[14]、调节宿主免疫和新陈代谢过程中发挥着关键作用[15]。脂质代谢异常会引起宿主的代谢疾病发生, 在新陈代谢过程中, 正常的脂代谢对宿主维持能量稳态发挥着重要作用。
2.1 脂肪源类型对鱼类肠道菌群的影响鱼油一直以来都是用来作为肉食性鱼类的主要脂肪源, 但是近年来, 随着水产养殖业的迅猛发展, 全球的鱼油消耗量由16%猛增到81% (占全球鱼油产量)[16]。尽管许多研究都致力于寻找替代鱼油的合适脂肪源, 但结果大多不尽人意。Rhodes等[17]研究发现, 日粮中亚麻油[富含n-3长链脂肪酸(long-chain fatty acids, LC-PUFAs)]和玉米油[富含n-6长链脂肪酸(long-chain fatty acids, LC-PUFAs)]全部替代鱼油会导致裸盖鱼(Anoplopoma fimbria)肠黏膜上液泡和肠上皮细胞显著减少、肝胆管出现畸形和肝细胞损伤等。对肠道菌群结构分析的结果表明, 植物油全部替代后裸盖鱼肠道菌群的组成发生了明显变化, 相对于对照日粮, 玉米油组和亚麻油组菌群组成减少, 慢生根瘤菌科(Bradyrhizobiaceae)和棒状杆菌科(Corynebacteriaceae)为玉米油组特有类群, 心杆菌科(Cardiobacteriaceae)为亚麻油组特有类群。此外, 在虹鳟中的研究发现, 以植物油100%替代鱼油后, 肠道菌群中厚壁菌门(Firmicutes)占支配地位, 而饲喂鱼油的虹鳟肠道内则主要为变形菌门(Proteobacteria)[18-19]。但也有研究表明, 饲料中少量添加百里香植物油, 饲喂虹鳟5周, 对其肠道菌群并无显著性影响[20], 以柠檬香草和天竺葵提取油替代鱼油饲喂尼罗罗非鱼(Oreochromis niloticus)12周, 可以显著降低肠道总菌数量, 其中大肠杆菌(Escherichia coli)、气单胞菌(Aeromonas spp.)数量下降明显[21]。因此, 植物性油脂替代鱼油对于鱼类肠道菌群究竟会产生怎样的影响, 应依据植物油组成、替代比例及养殖周期长短来进行分析, 同时, 也应注意菌群分析方法对实验结果造成的影响。如很多植物油中含有的萜类化合物(α多蒎烯、柠檬油精)具有疏水性, 更易结合到细菌细胞壁的脂质层, 因而对病原菌有显著抑制作用[21], 而有些植物油多不饱和脂肪酸含量较低, 易对鱼类肠道菌群产生不利影响。
2.2 脂肪水平对鱼类肠道菌群的影响除脂肪种类外, 鱼类肠道菌群的组成结构还会受到饲料中脂肪水平的影响。Wong等[22]选择了模式生物斑马鱼进行试验, 对其分别饲喂高、中、低3种不同脂肪含量的饲料, 观察斑马鱼生长过程中肠道菌群的变化, 结果发现:不同脂肪含量饲料饲喂条件下, 斑马鱼肠道菌群的组成结构呈现年龄依赖性(age-dependent), 受精后10 d, 高脂斑马鱼组与低脂组相比, 有2个可操作分类单元(operational taxonomic units, OTU)出现显著富集, 而到35 d时, 有1个OTU显著性富集, 而有13个OTU消失, 到70 d时, 有8个OTU富集, 其中梭杆菌门(Fusobacteria)是在成体中丰富度较高的物种, 而另有7个消失。对比发现, 高脂日粮加速了斑马鱼肠道菌群的成年化。在对虹鳟(Oncorhynchus mykiss Walbaum)的研究中, Lesel等[23]通过给鱼投喂低脂(50 g/kg)和高脂(160 g/kg)两种不同脂肪水平的饲料, 纯培养结果显示, 低脂组鱼的粪便中的主要细菌类群仅有不动杆菌(Acinetobacter spp.)和肠杆菌(Enterobacteria), 相比之下, 高脂组多样性则较高, 主要有不动杆菌(Acinetobacter spp.)、气单胞菌(Aeromonas spp.)、肠杆菌(Enterobacteria)、黄杆菌(Flavobacterium spp.)、假单胞菌(Pseudomonas spp.)和棒状杆菌(coryneforms)。总体上看, 关于高脂饮食对宿主肠道菌群的调控, 在哺乳动物中的研究较多, 而鱼类上目前研究还相对较少。有学者认为, 高脂饮食的摄入导致肠道(尤其是后肠)细菌总量、双歧杆菌属的细菌丰度减少, 而拟杆菌目和梭菌目细菌丰度相对增加[24]。双歧杆菌是肠道内有益菌的代表, 其数量的减少会影响肠道屏障功能的发挥。并且, 在许多动物和人类的实验研究均显示, 高脂饮食易诱导肠道内拟杆菌门细菌的减少, 而提高厚壁菌门细菌的丰度, 肠内厚壁菌门多于拟杆菌门会导致机体更有效地吸收食物中的热量, 从而导致肥胖[25-26]。从机制上分析, 细菌脂多糖(lipopolysaccharide, LPS)是革兰氏阴性菌外膜的一个组件, 高脂饮食下, 肠道通透性增加, 肠道内革兰氏阴性菌所占比例相对增加, 随着细菌的凋亡与再生, 机体血液中LPS含量也升高, 从而引发炎症反应及相关代谢类疾病[27]。此外, 饲料脂肪水平除了会影响鱼类肠道菌群的结构组成, 还会影响鱼类肠道消化酶的活性, 而这也可能跟肠道菌群的变化相关。韩光明等[28]研究了饲料中不同脂肪添加水平与肠道消化酶活性的关系, 发现高脂肪水平的饲料导致吉富罗非鱼肌肉脂肪含量显著增加, 胃和肠道中脂肪酶的活性显著降低。
3 鱼类肠道菌群与机体脂质代谢的关系 3.1 肠道菌群与脂质代谢的因果关系肠道菌群与机体脂质代谢密切相关, 但关于肠道菌群改变与机体脂质代谢异常之间的因果关系在很长一段时期里都不明确。2012年, 哺乳动物相关研究证实, 某些肠道微生物可能是导致机体脂质代谢紊乱和代谢类疾病的“成因”[29]。Zhao和Fei[30]通过无菌小鼠试验, 发现将一株从肥胖病人体内分离的阴沟肠杆菌植入无菌小鼠肠道后, 会引起小鼠的脂代谢异常, 并出现肥胖症状。由于该研究遵循病原菌是导致疾病发生的“科赫法则(Koch’s postulates)”, 因此认为肠道菌群组成改变是导致肥胖的原因而非结果。正常的肠道菌群组成对于维持脂质代谢平衡有着举足轻重的作用, 当肠道微生态环境紊乱, 肠道屏障会受到破坏, 肠黏膜通透性增加, 某些肠道菌群的代谢产物能够通过肠壁吸收和肠肝循环作用进入血液中, 过多的有害物质(如LPS、氧化三甲胺)直接入肝, 促进炎症因子的产生, 继而引发机体慢性炎症、脂代谢紊乱和胰岛素抵抗等代谢类疾病。研究发现通过菌群移植技术, 将人类志愿者肠道内与大麦谷粒纤维消化相关的菌群移植到无菌小鼠后, 其葡萄糖代谢明显得到改善, 并且普氏菌属(Prevotella)的丰度明显增加, 肝糖原含量相较于阴性无效菌群移植小鼠, 也存在显著提升[31]。同时, 我们也应该认识到, 当机体出现代谢紊乱或免疫疾病时, 宿主的生理状态势必会出现变化, 这种变化会引起内分泌激素改变等一系列的生理反应, 进而通过肠肝轴循环等途径进入肠道, 引发一些特定微生物种群结构和丰度的变化, 肠道菌群的失衡又将复作用于机体脂质代谢, 引发更加严重的代谢疾病[32]。
3.2 鱼类肠道菌群对机体脂质代谢的影响此前很多学者认为, 鱼类肠道菌群结构单一、数量稀少。而随着免培养测序技术的发展及纯培养技术的完善, 越来越多的证据表明鱼类也同样拥有足够复杂的微生物群落。鱼类胃肠道内存在的这些微生物类群, 在调节机体脂质代谢、脂肪的储存、运输过程中发挥着重要作用。Meng等[33]以水体铜对鲤进行暴露, 发现鲤肠道菌群结构发生明显变化, 一些短链脂肪酸产生菌如Allobaculum、Blautia等丰度显著下降, 且肝脏脂肪合成基因显著下调, 脂肪分解相关基因表达显著升高, 并且肠道菌群结构的变化与脂质代谢存在显著的相关性。Semova等[34]在无菌斑马鱼的研究中发现, 通过向肠道内定植菌群能够促进肠上皮细胞对脂肪酸(fatty acid, FA)的吸收, 增加脂滴(Lipid droplet, LD)在肠上皮细胞中的积累, 并且也能增加肠道外周组织的脂肪酸含量。进一步, 以无菌斑马鱼和抗生素处理的斑马鱼为工具, Sheng等研究发现, 肠道菌群的存在不仅可促进斑马鱼肠道上皮脂肪的累积, 还可调控apoa4、hsl、cox15、slc2a1a和lss等与脂质代谢密切相关的基因表达[35]。Bates等[36]则发现无菌斑马鱼幼体的肠道不能对大分子蛋白进行吸收利用, 原因是相较于正常个体, 无菌斑马鱼幼体机体缺乏法呢酰基二磷酸合成酶(farnesyl diphosphate synthase, FDS)和载体蛋白B(apoB)。然而, 所有这些不良性状都会随微生物的加入而得到改善。该研究也进一步证实了微生物在宿主脂质代谢中的重要作用。此外, 有研究显示, 鱼类肠道不同部位的微生物组成差异导致其生物学功能不同。对草鱼前、中、后肠肠道菌群进行功能预测及分子生态网络分析, 结果表明, 后肠与碳水化合物代谢相关的功能基因显著富集, 而与脂质代谢相关的基因(甘油脂代谢、脂肪酸代谢、脂质生物合成)则在草鱼中肠显著富集[37]。
3.3 鱼类肠道菌群在调控脂质代谢过程中可能的作用机制随着对肠道特征性菌群与宿主脂质代谢相关性的深入研究, 深入地解析二者的互作机制已成为学界进一步关注的焦点。根据肠腔内底物(氨基酸、脂类和碳水化合物)的不同, 肠道内细菌能够派生多种特殊代谢产物。基于此, 目前关于肠道菌群调控动物脂代谢的机制(图 1)主要包括: (1)调节肠源性SCFAs产生。SCFAs作为其中一种重要的菌群代谢物颇受人们关注。碳水化合物在肠道内通过微生物的作用形成乙酸、丙酸、丁酸和乳酸, 这些SCFAs的相对比例和丰度变化都会对宿主产生影响。并且, 不同的SCFAs对宿主发挥的生物学功能也有所差异。比如, 丁酸是结肠上皮细胞的主要能量物质[38-39], 乙酸理论上常被作为参与生成胆固醇和脂肪酸的前体, 而丙酸则主要参与肝脏和肠道的糖异生作用[40-41]。因此, SCFAs被认为是肠道菌群影响宿主代谢的关键信使因子。在小鼠和斑马鱼中的研究显示, 多形拟杆菌(Bacteroides thetaiotaomicron)或产甲烷古菌(Methanobrevibacter smithii)通过发酵将食物多糖转变为SCFAs (包括乙酸、丙酸和丁酸), 进而诱导肠道上皮或脂肪组织G蛋白偶联受体GPR41/43 (FFAR2/FFAR3)高表达并与SCFAs结合促进脂肪的累积[42-43]; (2)调控脂多糖(LPS)或肽聚糖的产生。肠道革兰氏阴性菌死亡后释放的LPS可以和LPS结合蛋白及下游受体CD14形成复合物, 经细胞表面TLR4-MD2识别后激活胞内反应, 引发胰岛素抵抗和慢性炎症[44]; (3)调节食物胆碱新陈代谢。小鼠和人类肠道γ-变形菌和产芽孢菌群所产酶蛋白可促进胆碱转化为三甲胺(TMA), 进一步在肝脏中经黄素单氧酶系转变为氧化三甲胺(TMAO), 进而导致糖脂代谢紊乱[45]; (4)调节胆汁酸代谢。胆汁酸可通过肠肝循环促进日粮脂肪和脂溶性维生素的吸收, 但人肠道中拟杆菌、梭菌、真细菌、乳酸菌、埃希氏杆菌等均可产生胆酸盐水解酶, 通过改变胆汁酸代谢(产生第二胆汁酸)及影响机体能量代谢信号通路TGR5而诱发脂肪沉积[46]。进一步研究发现, 肠道菌群的不同代谢产物在与各自受体结合后, 会引发肠上皮内分泌激素分泌表达的变化。如胰高血糖素样肽1 (glucagon-like peptide 1, GLP-1)、胰高血糖素样肽2 (glucagon-like peptide 2, GLP-2)及多肽YY (polypeptide YY, PYY), 最终引发下游各机体靶器官的糖脂代谢变化[47]。此外, Velagapudi等[48]通过普通小鼠与无菌小鼠对比试验, 发现血清、脂肪组织和肝脏中甘油三酯含量和储存形式均存在巨大差异。其中, 肝脏中超低密度脂蛋白甘油三酯(very low-density lipoprotein triglyceride, VLDL triglyceride)的产生速率和甘油三酯水平在普通小鼠上均较高, 但是其血清甘油三酯水平却低于无菌小鼠。分析发现, 这种差异是由于普通小鼠脂蛋白脂肪酶(lipoprotein lipase, LPL)相比无菌小鼠要高, 促进了甘油三酯在脂肪组织中的沉积, 使得血清中甘油三酯清除率显著提高[49-50]。在鱼类研究中, Camp等[51]同样利用斑马鱼模型进行研究, 发现相比于无菌斑马鱼, 肠道菌群的定植抑制了肠道上皮LPL抑制物血管生成素样蛋白4 (Angptl4/Fiaf)基因的表达, 从而促进了LPL的产生。该项研究成果与在小鼠上的研究结论保持一致, 为深入了解肠道微生物影响脂肪储存的机制提供了新的途径。
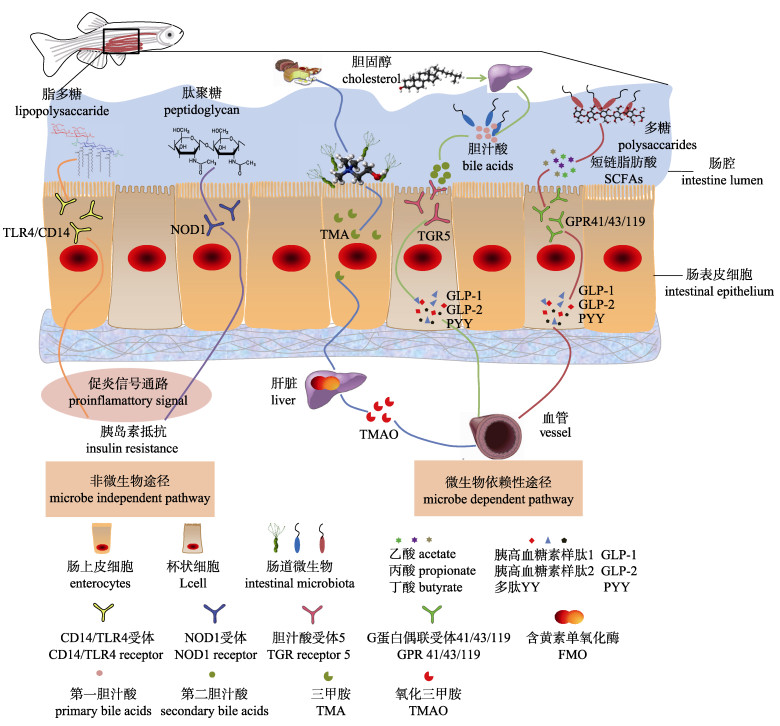
|
图 1 肠道脂质代谢调控菌群依赖/非依赖性作用途径 Fig.1 The pathway of lipid metabolism regulated by gut microbiota dependent or independent |
总之, 肠道菌群的组成结构受食物中营养物质组成和肠道内环境的影响, 肠道菌群的变化必然会导致相关代谢产物和机体对营养物质的吸收效率改变, 进而影响一系列下游与机体营养代谢相关的信号因子和神经递质等的分泌表达, 肠道菌群与宿主之间的这种交互作用最终会作用于不同的器官和大脑, 从而影响体内能量的平衡和脂质代谢。
4 基于肠道菌群调控鱼类脂质代谢的策略除了养殖水环境外, 鱼类肠道微生物类群的组成变化主要取决于饵料的组成。因此, 鱼类肠道微生态的平衡与饵料的安全性息息相关。近年来, 水产饲料业迅猛发展, 植物蛋白源替代鱼粉, 植物油替代鱼油已经成为一种常态。但众多研究显示, 鱼粉鱼油替代会损伤肠道健康, 改变肠道上皮组织结构, 引起机体代谢紊乱或免疫损伤。如利用脱脂蚕蛹替代鱼粉投喂建鲤(Cyprinus carpiovar Jian), 结果发现, 建鲤肠道菌群的组成显著变化, 随着脱脂蚕蛹替代水平的提高, 肠道菌群多样性下降, 但通过向饲料中补充赖氨酸可减弱这种不良影响[52]。以植物油替代鱼油, 结果显示, 欧洲海鲈前肠脂肪沉积显著增加, 机体的脂质代谢和脂蛋白合成发生变化, 并且梭杆菌属(Clostridium)、棒状杆菌属(Cornybacterium spp.)、葡萄球菌属(Staphylococcus)和罗氏菌属(Roseburia faecis)仅在植物油替代组中发现[53]。因此, 从饲料原料的角度出发, 寻找合适的鱼粉、鱼油替代物, 并研究最适添加剂量和配比组成, 对维持鱼类肠道稳态, 促进机体脂质代谢十分重要。
此外, 益生菌、益生元的使用对维持肠道微生态至关重要。研究发现, 通过添加鼠李糖乳杆菌(Lactobacillus rhamnosus)饲喂斑马鱼幼鱼, 其肠道厚壁菌门显著增多, 放线菌门减少, 并且诱导脂质代谢过程中甘油三酯、胆固醇代谢相关基因(fit2, agpat4, dgat2, mgll, hnf4α, scap, cck)表达显著下调, 微绒毛长度增加, 肠上皮细胞脂滴大小显著降低[54]。以低聚果糖、低聚木糖、甘露寡糖饲喂海鲈, 可明显降低其肠道菌群多样性, 降低脂肪合成酶活性, 改变肝脏及肌肉的脂肪酸谱, 增加多不饱和脂肪酸的沉积[55-56]。目前, 研究较多的益生元有菊粉、低聚果糖(fructooligosaccharide, FOS)、短链低聚果糖(short-chain fructooligosaccharide, scFOS)、甘露寡糖(mannose-oligosaccharide, MOS)、反式低聚半乳糖(trans-galactooligosaccharide, TOS)、低聚半乳糖(galactooligosaccharide, GOS)、低聚木糖(xylooligosaccharide, XOS)、阿拉伯木聚糖(arabinoxylan oligosaccharide, AXOS)、低聚异麦芽糖(isomalto-oligosaccharide, IMO)等[57]。在未来鱼类营养代谢的研究过程中, 要不断的筛选新型土著益生菌, 开发新的益生元, 对新型益生菌(如Akkermansia muciniphila)、新型益生元(如菊粉)对机体糖脂代谢调控的作用效果、安全性予以评价。同时, 建议基于微生物纯培养手段, 针对性的筛选导致不同鱼类脂质代谢紊乱的关键菌株, 并对其开展深入研究, 探寻致病机制, 寻找解决方案。
5 小结越来越多的研究表明, 肠道菌群的改变能够引起机体脂代谢水平的变化, 而其中的具体作用机制有很多目前还属未知, 亟待我们进一步去深入探究。维持肠道菌群长期处于一种健康的稳态对于鱼类的正常生长和脂质代谢至关重要, 在水产养殖行业中, 相关的研究还处在起始阶段, 许多作用机理还不够清楚和完善。一些新型益生菌、微生态制剂、中草药提取物和抗生素等在水产养殖上的应用仍需大量科学实验作为支撑, 应避免急功近利, 考量多方面因素, 以防此类产品在投入使用过程中出现一些不良效果或恶劣事件。鉴于此, 当下应在哺乳动物相关先行研究的指导下, 着力于探索和明确鱼类肠道菌群组成结构与机体脂代谢之间的关系及其相关作用机制, 并以此为基础, 开展鱼类肠道益生菌筛选和新型微生态制剂的研发与应用研究, 这势必将为鱼类等水产动物脂质代谢类疾病的防治及绿色健康养殖模式的实施提供理论支撑, 进而推动整个水产养殖业的健康可持续发展。
| [1] |
Llewellyn M S, Boutin S, Hoseinifar S H, et al. Teleost microbiomes:the state of the art in their characterization, manipulation and importance in aquaculture and fisheries[J]. Frontiers in Microbiology, 2014, 5: 207. |
| [2] |
Fischbach M A, Sonnenburg J L. Eating for two:How metabolism establishes interspecies interactions in the gut[J]. Cell Host & Microbe, 2011, 10(4): 336-347. |
| [3] |
Xu J, Gordon J I. Honor thy symbionts[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(18): 10452-10459. DOI:10.1073/pnas.1734063100 |
| [4] |
Reed G M, Spence C M. The intestinal and slime flora of the haddock:a preliminary report[J]. Contributions to Canadian Biology and Fisheries, 1929, 4(1): 257-264. DOI:10.1139/f29-019 |
| [5] |
Wang A R, Ran C, Ringø E, et al. Progress in fish gastrointestinal microbiota research[J]. Reviews in Aquaculture, 2018, 10(3): 626-640. DOI:10.1111/raq.12191 |
| [6] |
Meng X L, Li W J, Nie G X. Effect of different factors on the fish intestinal microbiota[J]. Journal of Fisheries of China, 2019, 43(1): 143-155. [孟晓林, 李文均, 聂国兴. 鱼类肠道菌群影响因子研究进展[J]. 水产学报, 2019, 43(1): 143-155.] |
| [7] |
Nayak S K. Role of gastrointestinal microbiota in fish[J]. Aquaculture Research, 2010, 41: 1553-1573. DOI:10.1111/j.1365-2109.2010.02546.x |
| [8] |
Blanch A R, Alsina M, Simón M, et al. Determination of bacteria associated with reared turbot (Scophthalmus maximus) larvae[J]. Journal of Applied Microbiology, 1997, 82(6): 729-734. DOI:10.1046/j.1365-2672.1997.00190.x |
| [9] |
Verner-Jeffreys D W, Shields R J, Bricknell I R, et al. Changes in the gut-associated microflora during the development of Atlantic halibut (Hippoglossus hippoglossus L.) larvae in three British hatcheries[J]. Aquaculture, 2003, 219(1-4): 21-42. DOI:10.1016/S0044-8486(02)00348-4 |
| [10] |
Austin B. The bacterial microflora of fish[J]. The Scientific World Journal, 2002, 2: 558-572. DOI:10.1100/tsw.2002.137 |
| [11] |
Gómez G D, Balcázar J L. A review on the interactions between gut microbiota and innate immunity of fish[J]. FEMS Immunology & Medical Microbiology, 2008, 52(2): 145-154. |
| [12] |
Ghanbari M, Kneifel W, Domig K J. A new view of the fish gut microbiome:Advances from next-generation sequencing[J]. Aquaculture, 2015, 448: 464-475. DOI:10.1016/j.aquaculture.2015.06.033 |
| [13] |
Sargent J R, Tocher D R, Bell J G. The lipids[M]. San Diego: Academic Press, 2003: 181-257.
|
| [14] |
Zalatan F, Black P. Characterization of long-chain fatty acid uptake in Caulobacter crescentus[J]. Archives of Microbiology, 2011, 193(7): 479-487. DOI:10.1007/s00203-011-0694-9 |
| [15] |
Miles E A, Calder P C. Fatty acids, lipid emulsions and the immune and inflammatory systems[J]. World Review of Nutrition & Dietetics, 2015, 112: 17-30. |
| [16] |
Tacon A G J, Metian M. Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds:Trends and future prospects[J]. Aquaculture, 2008, 285(1-4): 146-158. DOI:10.1016/j.aquaculture.2008.08.015 |
| [17] |
Rhodes L D, Johnson R B, Myers M S. Effects of alternative plant-based feeds on hepatic and gastrointestinal histology and the gastrointestinal microbiome of sablefish (Anoplopoma fimbria)[J]. Aquaculture, 2016, 464: 683-691. DOI:10.1016/j.aquaculture.2016.05.010 |
| [18] |
Ingerslev H C, von Gersdorff Jorgensen L, Lenz Strube M, et al. The development of the gut microbiota in rainbow trout (Oncorhynchus mykiss) is affected by first feeding and diet type[J]. Aquaculture, 2014, 424-425: 24-34. DOI:10.1016/j.aquaculture.2013.12.032 |
| [19] |
Ingerslev H C, Strube M L, von Gersdorff Jørgensen L, et al. Diet type dictates the gut microbiota and the immune response against Yersinia ruckeri in rainbow trout (Oncorhynchus mykiss)[J]. Fish & Shellfish Immunology, 2014, 40(2): 624-633. |
| [20] |
Navarrete P, Toledo I, Mardones P, et al. Effect of Thymus vulgaris essential oil on intestinal bacterial microbiota of rainbow trout, Oncorhynchus mykiss (Walbaum) and bacterial isolates[J]. Aquaculture research, 2010, 41(10): e667-e678. |
| [21] |
Al-Sagheer A A, Mahmoud H K, Reda F M, et al. Supplementation of diets for Oreochromis niloticus with essential oil extracts from lemongrass (Cymbopogon citratus) and geranium (Pelargonium graveolens) and effects on growth, intestinal microbiota, antioxidant and immune activities[J]. Aquaculture Nutrition, 2018, 24(3): 1006-1014. DOI:10.1111/anu.12637 |
| [22] |
Wong S, Stephens W Z, Burns A R, et al. Ontogenetic differences in dietary fat influence microbiota assembly in the zebrafish gut[J]. mBio, 2015, 6(5): e00687-15. DOI:10.1128/mBio.00687-15 |
| [23] |
Lesel R, de la Noue J, Choubert G. Fecal bacterial flora of rainbow trout under antibiotic treatment:effect of the number of pyloric caeca and the lipid content of food[M]. Bredane: European Aquaculture Society, 1989: 897-903.
|
| [24] |
Moreira A P B, Texeira T F S, Ferreira A B, et al. Influence of a high-fat diet on gut microbiota, intestinal permeability and metabolic endotoxaemia[J]. British Journal of Nutrition, 2012, 108(5): 801-809. DOI:10.1017/S0007114512001213 |
| [25] |
Turnbaugh P J, Ley R E, Mahowald M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [26] |
Fischbach M A, Segre J A. Signaling in host-associated microbial communities[J]. Cell, 2016, 164(6): 1288-1300. DOI:10.1016/j.cell.2016.02.037 |
| [27] |
Cani P D, Delzenne N M, Amar J, et al. Role of gut microflora in the development of obesity and insulin resistance following high-fat diet feeding[J]. Pathologie Biologie, 2008, 56(5): 305-309. DOI:10.1016/j.patbio.2007.09.008 |
| [28] |
Han G M, Wang A M, Xu P, et al. Effects of dietary lipid levels on growth, muscle composition and digestive enzyme activities of juvenile GIFT strain Nile tilapia, Oreochromis niloticus[J]. Journal of Shanghai Ocean University, 2010, 19(4): 469-474. [韩光明, 王爱民, 徐跑, 等. 饲料中脂肪水平对吉富罗非鱼幼鱼成活率、肌肉成分及消化酶活性的影响[J]. 上海海洋大学学报, 2010, 19(4): 469-474.] |
| [29] |
Zhao L P. The gut microbiota and obesity:from correlation to causality[J]. Nature Reviews Microbiology, 2013, 11(9): 639-647. DOI:10.1038/nrmicro3089 |
| [30] |
Fei N, Zhao L P. An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice[J]. The ISME Journal, 2013, 7(4): 880-884. DOI:10.1038/ismej.2012.153 |
| [31] |
Kovatcheva-Datchary P, Nilsson A, Akrami R, et al. Dietary fiber-induced improvement in glucose metabolism is associated with increased abundance of Prevotella[J]. Cell Metabolism, 2015, 22(6): 971-982. DOI:10.1016/j.cmet.2015.10.001 |
| [32] |
Turnbaugh P J, Bäckhed F, Fulton L, et al. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome[J]. Cell Host & Microbe, 2008, 3(4): 213-223. |
| [33] |
Meng X L, Li S, Qin C B, et al. Intestinal microbiota and lipid metabolism responses in the common carp (Cyprinus carpio L.) following copper exposure[J]. Ecotoxicology and Environmental Safety, 2018, 160: 257-264. DOI:10.1016/j.ecoenv.2018.05.050 |
| [34] |
Semova I, Carten J D, Stombaugh J, et al. Microbiota regulate intestinal absorption and metabolism of fatty acids in the zebrafish[J]. Cell Host & Microbe, 2012, 12(3): 277-288. |
| [35] |
Sheng Y, Ren H, Limbu S M, et al. The presence or absence of intestinal microbiota affects lipid deposition and related genes expression in zebrafish (Danio rerio)[J]. Frontiers in Microbiology, 2018, 9: 1124. DOI:10.3389/fmicb.2018.01124 |
| [36] |
Bates J M, Akerlund J, Mittge E, et al. Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota[J]. Cell Host & Microbe, 2007, 2(6): 371-382. |
| [37] |
Yang G, Jian S Q, Cao H Z, et al. Changes in microbiota along the intestine of grass carp (Ctenopharyngodon idella):Community, interspecific interactions, and functions[J]. Aquaculture, 2019, 498: 151-161. DOI:10.1016/j.aquaculture.2018.08.062 |
| [38] |
Al-Lahham S H, Peppelenbosch M P, Roelofsen H, et al. Biological effects of propionic acid in humans; metabolism, potential applications and underlying mechanisms[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2010, 1801(11): 1175-1183. |
| [39] |
Cummings J H, Pomare E W, Branch W J, et al. Short chain fatty acids in human large intestine, portal, hepatic and venous blood[J]. Gut, 1987, 28(10): 1221-1227. DOI:10.1136/gut.28.10.1221 |
| [40] |
Delzenne N M, Williams C M. Prebiotics and lipid metabolism[J]. Current Opinion in Lipidology, 2002, 13(1): 61-67. DOI:10.1097/00041433-200202000-00009 |
| [41] |
de Vadder F, Kovatcheva-Datchary P, Goncalves D, et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J]. Cell, 2014, 156(1-2): 84-96. DOI:10.1016/j.cell.2013.12.016 |
| [42] |
Bjursell M, Admyre T, Göransson M, et al. Improved glucose control and reduced body fat mass in free fatty acid receptor 2-deficient mice fed a high-fat diet[J]. American Journal of Physiology-Endocrinology and Metabolism, 2011, 300: E211-E220. DOI:10.1152/ajpendo.00229.2010 |
| [43] |
Samuel B S, Shaito A, Motoike T, et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(43): 16767-16772. DOI:10.1073/pnas.0808567105 |
| [44] |
Cani P D, Bibiloni R, Knauf C, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice[J]. Diabetes, 2008, 57(6): 1470-1481. DOI:10.2337/db07-1403 |
| [45] |
Spencer M D, Hamp T J, Reid R W, et al. Association between composition of the human gastrointestinal microbiome and development of fatty liver with choline deficiency[J]. Gastroenterology, 2011, 140(3): 976-986. DOI:10.1053/j.gastro.2010.11.049 |
| [46] |
Thomas C, Gioiello A, Noriega L, et al. TGR5-mediated bile acid sensing controls glucose homeostasis[J]. Cell Metabolism, 2009, 10(3): 167-177. DOI:10.1016/j.cmet.2009.08.001 |
| [47] |
Everard A, Cani P D. Gut microbiota and GLP-1[J]. Reviews in Endocrine and Metabolic Disorders, 2014, 15(3): 189-196. DOI:10.1007/s11154-014-9288-6 |
| [48] |
Velagapudi V R, Hezaveh R, Reigstad C S, et al. The gut microbiota modulates host energy and lipid metabolism in mice[J]. Journal of Lipid Research, 2010, 51(5): 1101-1112. DOI:10.1194/jlr.M002774 |
| [49] |
Bäckhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [50] |
Bäckhed F, Manchester J K, Semenkovich C F, et al. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(3): 979-984. DOI:10.1073/pnas.0605374104 |
| [51] |
Camp J G, Jazwa A L, Trent C M, et al. Intronic, Cis-regulatory modules mediate tissue-specific and microbial control of angptl4/fiaf transcription[J]. PLoS Genetics, 2012, 8(3): e1002585. DOI:10.1371/journal.pgen.1002585 |
| [52] |
Zhong L, Ji H, Xia Y, et al. Effect of substituting dietary fish meal with defatted silkworm pupae on the intestinal bacterial community structure of Jian carp, Cyprinus carpio var. jian[J]. Journal of Fishery Sciences of China, 2014, 21(3): 531-540. [钟雷, 吉红, 夏耘, 等. 脱脂蚕蛹替代日粮中鱼粉对建鲤肠道菌群的影响[J]. 中国水产科学, 2014, 21(3): 531-540.] |
| [53] |
Torrecillas S, Mompel D, Caballero M J, et al. Effect of fishmeal and fish oil replacement by vegetable meals and oils on gut health of European sea bass (Dicentrarchus labrax)[J]. Aquaculture, 2017, 468: 386-398. DOI:10.1016/j.aquaculture.2016.11.005 |
| [54] |
Falcinelli S, Picchietti S, Rodiles A, et al. Lactobacillus rhamnosus lowers zebrafish lipid content by changing gut microbiota and host transcription of genes involved in lipid metabolism[J]. Scientific Reports, 2015, 5: 9336. DOI:10.1038/srep09336 |
| [55] |
Torrecillas S, Montero D, Caballero M J, et al. Effects of dietary concentrated mannan oligosaccharides supplementation on growth, gut mucosal immune system and liver lipid metabolism of European sea bass (Dicentrarchus labrax) juveniles[J]. Fish & Shellfish Immunology, 2015, 42(2): 508-516. |
| [56] |
Guerreiro I, Oliva-Teles A, Enes P. Improved glucose and lipid metabolism in European sea bass (Dicentrarchus labrax) fed short-chain fructooligosaccharides and xylooligosaccharides[J]. Aquaculture, 2015, 441: 57-63. DOI:10.1016/j.aquaculture.2015.02.015 |
| [57] |
Ringø E, Dimitroglou A, Hoseinifar S H, et al. Prebiotics in finfish: an update[M]//Merrifield D L, Ringø E (eds). Aquaculture Nutrition: Gut Health, Probiotics and Prebiotics. Chichester: John Wiley & Sons, 2014: 360-400.
|
 2019, Vol. 26
2019, Vol. 26

