6-磷酸葡萄糖酶催化亚基(glucose-6-phosphatase catalytic subunit, G6PC)为6-磷酸葡萄糖酶(glucose- 6-phosphatase, G6Pase, EC 3.1.3.9)的组成成分[1], 研究表明, G6PC在生物体内催化6-磷酸葡萄糖水解生成葡萄糖和磷酸, 为糖异生和糖原分解的最后一步反应。G6Pase能够调节生物体内血糖水平, 是维持血糖平衡的关键酶之一[2-3]。其中, 6-磷酸葡萄糖酶家族共有3个成员, 分别为G6pase-α (G6pc编码)、胰岛素特异性葡萄糖-6-磷酸相关蛋白(IGRP) (G6pc2编码)和G6pase-β (G6pc3编码)[4]。值得关注的是, 一般哺乳动物中g6pc只有1个亚型, 而因为基因组加倍事件, 大部分鱼类存在多个亚型, 如斑马鱼(Danio rerio)存在g6pca、g6pcb1和g6pcb2; 虹鳟(Oncorhynchus mykiss)存在g6pca、g6pcb1a、g6pcb1b、g6pcb2a和g6pcb2b[5-6]。鱼类g6pc的相关研究在金头鲷(Sparus aurata)[7-8]和虹鳟[9-12]中较多, 在鲈(Lateolabrax japonicus)[13]、文昌鱼(Branchiostoma japonicum)[14]和罗非鱼(Oreochromis niloticus)[15]等也有一些研究。与哺乳动物g6pc一样, 鱼类的g6pca和g6pcb1主要在肝脏中表达, 肠道和肾脏中也存在, 而g6pcb2主要在心脏中表达, 在脑中也有发现, 如斑点雀鳝(Lepisosteus oculatus)、虹鳟等[6]。
哺乳动物肝脏中G6PC水平受到体内营养素和激素的调节, 如饥饿和胰高血糖素可以增加大鼠肝脏g6pc mRNA的表达水平, 而饥饿后再投喂和胰岛素可以抑制其表达[16-18]。目前, 营养素和激素对G6PC的调节作用仅在少数鱼类中报道, 比较复杂且存在物种特异性, 如长期饥饿能增加虹鳟[19]和金头鲷[7]肝脏G6PC的酶活性或表达水平, 而使黄金鲈(Perca flavescens)[20]肝脏中G6PC的酶活性降低。此外, 碳水化合物不影响金头鲷g6pc的表达[7], 而投喂含糖饲料可以增加翘嘴红鲌(Erythroculter ilishaeform) g6pc的表达水平[21], 短期投喂高糖饲料也可使斑马鱼幼鱼g6pc mRNA水平增加[22]。胰岛素对鱼类g6pc表达的影响与哺乳动物一致, 如胰岛素可以抑制虹鳟[23]和金头鲷[8] g6pc的表达。随着鱼类中g6pc发生基因加倍, 其不同亚型的功能也有相关研究, 虹鳟摄食高糖饲料后, 其肝脏中g6pca和g6pcb1 mRNA水平显著降低, 而g6pcb2 mRNA水平显著升高, 研究表明虹鳟中g6pc不同亚型之间存在功能分化[5, 24]。
草鱼(Ctenopharyngodon idellus)属于“四大家鱼”之一, 其生长快、肉质好, 是中国特有的淡水草食性经济养殖鱼类。与其他鱼类相比, 草鱼能较好地利用碳水化合物, 目前关于草鱼g6pc的研究大多数关注于脂类对其转录水平的影响, 如脂肪水平为107.9 g/kg的饲料投喂草鱼后, 其g6pc mRNA的表达水平增加[25-26], 有关碳水化合物对草鱼g6pc的影响研究较少。在本研究中, 以斑马鱼g6pc基因为参照序列, 应用多重比对方式在草鱼基因组中获取了3个g6pc基因序列, 并根据序列比对、系统进化树和同线性分析其序列的保守性。采用RT-PCR技术检测了g6pc基因的组织表达特异性。此外, 探讨了高糖饲料对草鱼肝脏中不同g6pc亚型转录水平的影响以及葡萄糖和胰岛素刺激草鱼肝细胞后对g6pca转录水平的影响, 为进一步研究草鱼不同g6pc亚型的功能奠定基础。
1 材料与方法 1.1 实验用鱼和细胞实验用草鱼购自武汉四汇水产科技有限公司(中国, 武汉), 饲养在农业农村部鳜鱼育种创新基地。草鱼肝细胞系(L8824)购自中国典型培养中心, 细胞贴壁生长, 在含5% CO2的28℃恒温培养箱内培养。
1.2 实验方法 1.2.1 草鱼g6pc基因识别、命名及基因结构分析应用斑马鱼g6pca (Ensembl; ENSDARG0000 0031616)、g6pcb1 (Ensembl; ENSDARG00000013 721)和g6pcb2基因(Ensembl; ENSDARG00000014 967)为参考序列, 使用本地Blast工具在草鱼基因组数据库(http://www.ncgr.ac.cn/grasscarp/)中进行比对, 采用双向Blast搜索对候选基因的准确性进行验证, 并将得到的g6pc序列在NCBI上比对, 确定其可靠性。最终, 根据比对的结果和g6pc系统进化树对草鱼3个g6pc基因进行命名。根据内含子以GT起始并以AG终止的原则, 分析获取的草鱼g6pc基因cDNA序列和基因组序列, 确定其编码序列的碱基组成。
1.2.2 草鱼g6pc的多重比对、系统进化树和同线性分析利用The Sequence Manipulation Suite (http://www.bio-soft.net/sms/)预测g6pca、g6pcb1和g6pcb2 CDS序列编码的氨基酸序列, 并使用在线软件ClustalW2 (http://www.ebi.ac.uk/Tools/msa/clustalw2/)与其他物种进行氨基酸序列多重比对。系统进化树和同线性分析使用了人(Homo sapiens)、鼠(Mus musculus)、斑马鱼(Danio rerio)、墨西哥脂鲤(Astyanax mexicanus)、花鳉(Poecilia formosa)、花斑剑尾鱼(Xiphophorus maculatus)、三刺鱼(Gasterosteus aculeatus)、红鳍东方鲀(Takifugu rubripes)、斑点雀鳝(Lepisosteus oculatus)和虹鳟(Oncorhynchus mykiss) 10个物种的G6PC氨基酸序列, 且均从Ensembl或GenBank数据库中获得。用ClustalW2对草鱼与上述10个物种的G6PC进行氨基酸序列多重比对后, 再用MEGA 6.0软件以邻接法(neighbor-joining, NJ)构建进化树(bootstrap=1000)。此外, 从Ensembl、GenBank或草鱼基因组数据库中获取人、鼠、草鱼、斑马鱼、墨西哥脂鲤和虹鳟g6pc上下游基因信息, 进行同线性分析。
1.2.3 RT-PCR检测草鱼g6pc的组织表达随机取同一养殖环境且大小均一的3尾草鱼, 用麻醉剂MS222 (20 mg/L) (Sigma, 美国)麻醉, 并在无菌条件下取草鱼的鳃、脂、脑、心脏、肝、肾、前肠、中肠、后肠和肌肉10个组织, 用液氮快速冷冻, 保存于–80℃冰箱备用。使用RNAiso Plus法提取上述组织的总RNA, 并用HiScript II Q RT SuperMix for qPCR (诺唯赞, 南京)反转录试剂盒进行体外反转录合成cDNA。利用Primer 6软件设计跨内含子定量引物(表 1), 并送生工生物工程股份有限公司(中国, 上海)合成。以草鱼转录延伸因子(ef1α)为内参, 用实时荧光定量PCR (RT-PCR)检测草鱼3个g6pc基因的组织表达。RT-PCR反应体系: ChamQ SYBR qPCR Master Mix (诺唯赞, 南京) 10 μL, 10 μmol的上游引物和下游引物各0.4 μL, 模板cDNA 1 μL, 用ddH2O将反应体系补足到20 μL。反应程序为95℃, 预变性5 min; 95℃变性15 s, Tm值58℃退火15 s(不同引物Tm不同)(表 1); 72℃延伸45 s, 40个循环。最后, 草鱼3个g6pc基因在各组织中的相对表达量用2–ΔΔCt的方法分析[27]。
|
|
表 1 荧光定量引物列表 Tab.1 Primers for RT-PCR |
正式实验之前, 用恒流曝气水将草鱼养在2 m3的养殖缸内, 并配有空气泵充氧, 每天8:00和17:00分别投喂1次, 以适应养殖条件2周。之后, 随机将草鱼分为两组, 分别用碳水化合物含量不同的饲料投喂7周, 投喂碳水化合物含量为25 g/kg的饲料组为对照组(control), 含量为42 g/kg的饲料组为高糖组(HC), 饲料配方在实验室之前的研究中已经阐明[28]。每组随机取5尾草鱼, 用MS222麻醉后, 取肝脏组织, 用液氮快速冷冻并于-80℃冰箱保存备用。用RT-PCR检测对照组和高糖组肝脏中3个g6pc基因的相对表达量。
1.2.5 葡萄糖和胰岛素对L8824中g6pca表达的影响L8824培养于M199完全培养基: M199基础培养基(Gibco, 美国)中添加10%的胎牛血清(Gibco, 美国)、1%的双抗(青霉素和链霉素各10万U/L) (Gibco, 美国), 并在含5% CO2的28℃恒温培养箱内培养。使用6孔板进行细胞实验, L8824的细胞铺板量为1.5×106个细胞/孔, 每孔添加2.5 mL M199完全培养基, 待细胞贴壁达70%~80%时, 弃掉培养基, 用1 mL DPBS洗涤后添加新的培养基。用葡萄糖测试盒(南京建成公司)检测出M199完全培养基的葡萄糖浓度为5 mmol/L, 本实验分为6个组: 5 mmol/L葡萄糖组(对照组) (M199完全培养基), 15 mmol/L葡萄糖组, 30 mmol/L葡萄糖组, 5 mmol/L葡萄糖+胰岛素组, 15 mmol/L葡萄糖+胰岛素组以及30 mmol/L葡萄糖+胰岛素组, 其中培养基中胰岛素(Sigma, 美国)浓度均为1 μmol/L。细胞换液后继续培养48 h, 并提取细胞RNA, 用RT-PCR检测对照组和实验组中g6pca的表达。
1.3 统计分析用SPSS Statistics 19.0统计软件分析实验数据。单样本T检验(one sample T-test)用来检测数据分布的正态性; 独立样本T检验(independent- sample T-test)用来分析两个样本之间的差异; 单因素方差分析(one-way ANOVA)用来检验多个样本之间的差异性; 数据均以平均值±标准误(x± SE)表示, 差异显著度为0.05。
2 结果与分析 2.1 草鱼g6pc基因的识别与命名草鱼基因组数据库中识别到3个g6pc基因, 在数目上与斑马鱼一致。通过序列比对和系统进化树分析结果来命名草鱼g6pc基因, 分别命名为g6pca、g6pcb1和g6pcb2。获得的g6pca基因长度为6377 bp, CDS序列长度为1062 bp, 编码353个氨基酸; g6pcb1基因的长度为2825 bp, CDS序列长度为1068 bp, 编码355个氨基酸; g6pcb2基因长度为1856 bp, CDS序列长度为1062 bp, 编码353个氨基酸。
2.2 草鱼g6pc的多重比对、进化树及同线性分析草鱼g6pca、g6pcb1和g6pcb2 CDS序列预测得到的氨基酸序列(序列已上传至NCBI, 登录号为MN176655、MN176656和MN176657)与其他物种多重比对显示, 草鱼g6pca与斑马鱼和虹鳟g6pca同源性较高, 为85%和73%, 与三刺鱼、红鳍东方鲀和墨西哥脂鲤等鱼类同源性较低, 为67%、66%和65%, 而与人和鼠的同源性更低, 为54%; g6pcb1与斑马鱼、墨西哥脂鲤和花鳉等同源性较高, 分别为94%、88%和81%, 与虹鳟g6pcb1a和g6pcb1b的同源性也较高, 分别为83%和81%, 同样与人和鼠的同源性较低, 均为64%; g6pcb2与斑马鱼和墨西哥脂鲤同源性较高, 分别为90%和71%, 与虹鳟g6pcb2a和g6pcb2b的同源性较低, 为65%和64%, 而与人和鼠的同源性更低, 分别为55%和53%。人、鼠、翘嘴红鲌和草鱼G6PC的氨基酸序列多重比对发现, 哺乳动物G6PC的3个结构域KWILFGQRP、PSGH和SRIYLAAHFPHQ在草鱼中较保守, 第二个结构域氨基酸序列在几个物种中相同, 第一个结构域在G6PCa、G6PCb1和G6PCb2的氨基酸序列中分别为KWVLFGERP、KWILFGERP和KWLMFGERP, 第三个结构域在G6PCa、G6PCb1和G6PCb2的氨基酸序列中分别为SRVYLAAHFPHQ、SRVFIAAH FPHQ和SRVFIAAHFPHQ (图 1)。

|
图 1 人、鼠、翘嘴红鲌和草鱼G6PC的氨基酸序列多重比对 Homo Sapiens:人(Ensembl: ENSP00000253801); Mus musculus:鼠(Ensembl: ENSMUSP00000019469); Erythroculter ilishaeform:翘嘴红鲌(GenBank: ABC49921.1);红色方框内是功能结构域, 标星号的是功能位点氨基酸. Fig.1 Amino acid sequences alignments of G6PC between human, mouse, Erythroculter ilishaeform and Ctenopharyngodon idellus Red box indicate function domains. Amino acids marked with an asterisk are functional site amino acids of G6PC. |
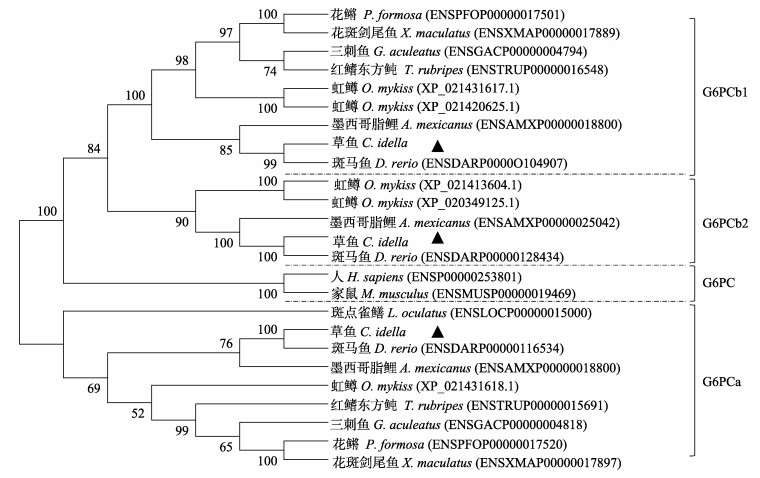
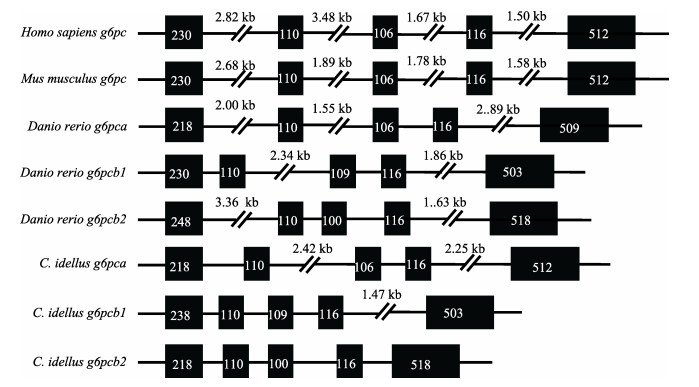
使用MEGA 6.0软件以邻接法构建草鱼与其他物种g6pc的系统进化树(图 2), 结果显示, 整个进化树被分为3簇, 即鱼类的g6pca为一簇, 位于进化树底端, 哺乳动物的g6pc形成一簇, 而鱼类的g6pcb1与g6pcb2形成另外一簇。草鱼g6pca、g6pcb1和g6pcb2与斑马鱼直系同源基因聚类关系最近, 其次为墨西哥脂鲤和虹鳟, 与哺乳动物的距离较远。另外, 分析草鱼g6pc基因结构发现, g6pca、g6pcb1和g6pcb2的CDS序列由5个外显子组成, 被4个内含子隔开, 这样的结构与人、鼠和斑马鱼相似, 且5个外显子的碱基数目在几个物种中十分接近, 只是它们内含子的长度差异较大(图 3)。
|
图 2 根据草鱼3个G6PC的氨基酸序列与其他物种的同源蛋白构建的系统进化树 基因在Ensembl或NCBI数据库中的编号在括号中给出. Fig.2 Phylogenetic tree derived from the amino acid sequences of three G6PCs in Ctenopharyngodon idellus and homologous proteins from various species All accession numbers (from Ensembl, or NCBI databases) are specified in parentheses. |
|
图 3 人、鼠、斑马鱼和草鱼g6pc编码序列的结构 Homo sapiens:人(Ensembl: ENST00000253801); Mus musculus:鼠(Ensembl: ENSMUST00000019469.2); Danio rerio g6pca:斑马鱼g6pca (Ensembl: ENSDART00000139419.3), Danio rerio g6pcb1 (Ensembl: ENSDART00000091868.6)和Danio rerio g6pcb2 (Ensembl: ENSDART00000156149.2);黑线表示内含子, 黑色方块表示外显子, 方框内数字表示编码序列长度(bp). Fig.3 The gene structures of coding sequence of g6pc genes in human, mouse, zebrafish and Ctenopharyngodon idellus The black lines indicate introns, and the black boxes indicate exons. The number in the box indicates the length of the code sequence (bp). |
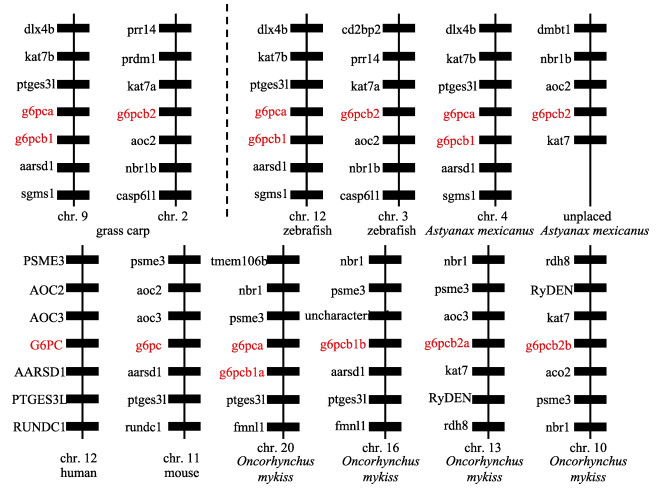
从Ensembl、GenBank和草鱼基因组数据库中获取了人、鼠、草鱼、斑马鱼、墨西哥脂鲤和虹鳟g6pc上下游基因信息, 发现鱼类的g6pca和g6pcb1在同一染色体上且相邻, 而g6pcb2在另一条染色体上。同线性分析发现草鱼g6pca和g6pcb1的上下游基因(dlx4b, kat7b, ptges3l, aarsd1和sgsm1)以及g6pcb2上下游基因(kat7a, aoc2, nbr1b)在斑马鱼和墨西哥脂鲤中高度保守, 而g6pca和g6pcb1邻近的aarsd1、ptges31和nbr1基因在哺乳动物和几个鱼类中均保守(图 4)。
|
图 4 人、鼠、草鱼、斑马鱼、墨西哥脂鲤和虹鳟g6pc基因的同线性分析 Fig.4 Synteny analyses of g6pc genes in human, mouse, Ctenopharyngodon idellus, zebrafish, Astyanax mexicanus and Oncorhynchus mykiss |
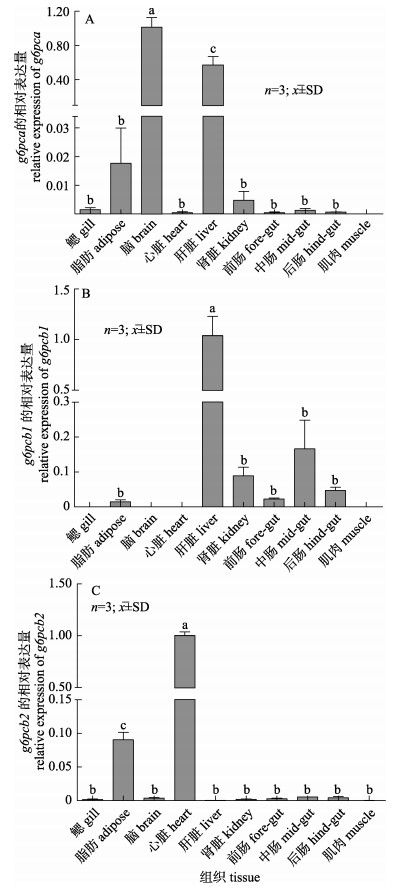
以草鱼ef1α基因为内参, RT-PCR检测到草鱼的g6pca在脑中表达量最高, 肝脏中的表达量是脑中的57%(P < 0.05), 脂肪组织中的表达量是脑中的2%(P < 0.05), 而在肾脏、鳃和中肠的表达量较低, 在心脏、前肠、后肠和肌肉中几乎不表达(图 5A)。g6pcb1在肝脏中表达量最高, 中肠的表达量是肝脏中的17%(P < 0.05), 肾脏中的表达量是肝脏的9%(P < 0.05), 而在脂肪组织、前肠和后肠的表达量较低, 在鳃、脑、心脏和肌肉中不表达(图 5B)。g6pcb2在心脏中表达量最高, 脂肪组织中的表达量是心脏的9%(P < 0.05), 其他组织中的表达量都普遍较低(图 5C)。
|
图 5 草鱼g6pca (A)、g6pcb1 (B)和g6pcb2 (C)在各组织中的相对表达量 标准差上方不同字母表示差异显著(P < 0.05). Fig.5 The relative expression of g6pca (A), g6pcb1 (B) and g6pcb2 (C) genes in different tissues of Ctenopharyngodon idellus Different letters above the error bars indicate significant differences (P < 0.05). |
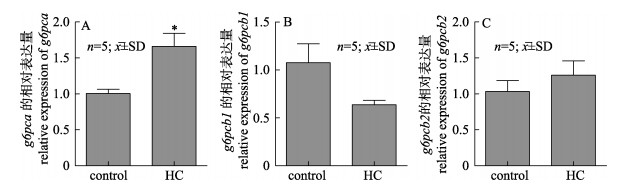
与对照组相比, 高糖组肝脏中g6pca mRNA水平显著上调(P < 0.05) (图 6A), g6pcb1 mRNA水平有上调趋势, 但是无显著性差异(P > 0.05, 图 6B), g6pcb2也没有显著性差异(P > 0.05, 图 6C)。
|
图 6 高糖饲料对草鱼肝脏g6pca (A)、g6pcb1 (B)和g6pcb2 (C) mRNA水平的影响 标准差上方标的星号表示与对照相比差异显著(P < 0.05). Fig.6 Effects of high-carbohydrate diet on mRNA levels of g6pca (A), g6pcb1 (B) and g6pcb2 (C) in Ctenopharyngodon idellus liver The asterisks above the error bars indicate significant differences compared with the control (P < 0.05). |
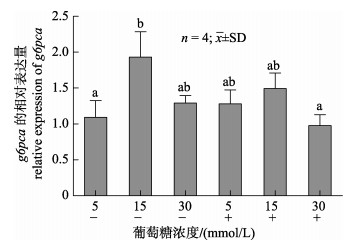
与对照组(5 mmol/L葡萄糖组)相比, 15 mmol/L葡萄糖组的g6pca mRNA水平显著增加(P < 0.05), 30 mmol/L葡萄糖组g6pca mRNA水平无显著变化(P > 0.05);不同浓度葡萄糖培养基中均添加1 μmol/L胰岛素后, g6pca mRNA水平与无胰岛素时的mRNA水平相比都无显著性差异(P > 0.05, 图 7)。
|
图 7 葡萄糖和胰岛素刺激48 h后对草鱼肝细胞系L8824 g6pca mRNA水平的影响
标准差上方不同字母表示差异显著(P < 0.05). “–”表示未添加胰岛素, “+”表示添加1 μmol/L胰岛素. Fig.7 Effects of glucose and insulin on g6pca mRNA of Ctenopharyngodon idellus cell line L8824 after 48 h stimulation "–" indicates no insulin supplement, "+" indicates 1 μmol/L insulin supplement. Different letters above the error bars indicate significant differences (P < 0.05). |
研究发现, 斑马鱼和某些鱼类g6pc基因的初始注释是不正确的, 实际上, 硬骨鱼类的系统发育树分析表明, g6pc基因第一次复制后生成g6pca和g6pcb, 然后才是g6pcb第二次复制成g6pcb1和g6pcb2[6]。本研究支持该观点, 故将采用新的g6pc基因命名方式(g6pca.1改命名为g6pca; g6pca.2改命名为g6pcb1; g6pcb改命名为g6pcb2)。草鱼G6PCa、G6PCb1和G6PCb2与其他鱼类G6PC的氨基酸序列同源性较高, 分别为64%~ 85%、77%~94%和64%~90%, 而与哺乳动物G6PC的同源性低很多, 与人的同源性分别为54%、64%和55%, 与鼠的同源性分别为54%、64%和53%。但是, 草鱼G6PC与人、鼠和翘嘴红鲌G6PC多重比对发现, 几个物种均含有PAP2结构域的3个保守基序(KXXXXXXRP, PSGH, SRX XXXXHXXXQ/D)[21], PAP2结构域为葡萄糖-6-磷酸酶亚家族PAP2类似蛋白结构域, 相关研究[29-31]表明, 3个基序的活化位点氨基酸在草鱼G6PC中分别为Lys72、Arg79、Ser113、Gly114、His115、Arg167和His173, 且与人、鼠和翘嘴红鲌高度保守, 表明草鱼的G6PC均具有正常的催化功能。系统进化树分析将鱼类g6pca分为一大支, 鱼类g6pcb1和g6pcb2分为另一支, 而哺乳动物的g6pc单独为一支, 其中草鱼3个g6pc基因均与其他物种的直系同源基因聚类。此外, 草鱼g6pca、g6pcb1和g6pcb2的CDS序列与人、鼠和斑马鱼类似, 均具有5个外显子, 且每个外显子的碱基个数在几个物种中非常接近, 这表明草鱼g6pc基因的mRNA剪接相对其他物种是保守的。而且草鱼与人、鼠、斑马鱼、墨西哥脂鲤和虹鳟g6pc同线性分析也显示, 草鱼的g6pc在染色体上的分布在斑马鱼、墨西哥脂鲤和虹鳟等保守。这表明草鱼g6pc在进化过程中所受的选择压力较大, 因此变异较小, 保守性很高。
3.2 草鱼g6pca、g6pcb1和g6pcb2的组织表达特异性一般哺乳动物中只有1个g6pc亚型, 且其酶活性主要在肝脏和肾脏中较强, 在脑和肠道等组织也存在活性[32]。本研究用RT-PCR技术, 检测草鱼g6pca、g6pcb1和g6pcb2基因在鳃、脂肪、脑、心、肝、肾、前肠、中肠、后肠和肌肉10个组织的相对表达量。结果显示, 草鱼g6pca在脑和肝脏中表达量较高, 脂肪组织中也有少量表达; g6pcb1在肝中表达量最高, 其次为中肠组织, 肾脏中有少量表达, 这与青鳉[6]中g6pcb1的组织表达特异性一致; 而草鱼g6pcb2与虹鳟[6]类似, 在心脏中的表达量最高, 其次为脂肪组织, 在其他组织中的表达量普遍较低。从草鱼g6pc基因的组织表达特异性上看, g6pca和g6pcb1在肝脏中表达量较高, 这与g6pc的功能相吻合, 即主要在糖异生作用的组织中表达, 目前普遍认为鱼类进行糖异生的主要器官为肝脏[33], 该结果也与斑马鱼中g6pca和g6pcb1的表达特性一致[6]。此外, g6pca在脑中也有较高的表达量, 表明g6pc基因在草鱼进化过程中, 可能衍生出未知的新功能, 但g6pcb2在心脏中的表达量最高, 在肝脏中却几乎不表达, 其在草鱼中的具体功能还需进一步研究。
3.3 碳水化合物和胰岛素对草鱼g6pc基因表达的影响哺乳动物的相关研究表明, 肝脏中g6pc的表达水平受到营养素的调节, 如饥饿可以增加大鼠肝脏中g6pc的mRNA水平, 而饥饿后再投喂可以抑制其表达[16, 18]。然而, 鱼类中营养素对g6pc表达的影响存在物种特异性, 如长期饥饿能增加虹鳟[19]和金头鲷[7]肝脏中G6PC的酶活性或表达水平, 而使黄鲈[20]肝脏中G6PC的酶活性降低。鲤摄食含糖饲料后其G6PC酶活性受到明显抑制[34], 但用碳水化合物含量分别为13.1%、26%和31.6%的饲料投喂金头鲷后, 其肝脏中g6pc的表达水平在各组之间无显著性差异[7]。本研究结果表明, 投喂草鱼高糖饲料7周后, 可以显著上调其肝脏g6pca mRNA的表达水平, 而对g6pcb1和g6pcb2无显著影响, 且葡萄糖刺激草鱼肝细胞48 h后对g6pca表达的影响与活体水平一致, 即与对照组相比, 15 mmol/L葡萄糖显著增加L8824的g6pca mRNA水平。在哺乳动物和鱼类中也存在类似的结果, 如20 mmol/L葡萄糖刺激大鼠肝细胞后, 其g6pc mRNA水平显著增加[35]; 用可消化糖量为23.98%的饲料投喂翘嘴红鲌后, 其肝脏g6pc的表达量也增加[21]; 虹鳟摄食高糖饲料(碳水化合物含量为30%)后, 肝脏中g6pca和g6pcb1b的mRNA水平显著降低, g6pcb1a的表达无显著性变化, 而g6pcb2的mRNA水平显著升高[5-6]。另外, 激素也会影响哺乳动物和鱼类g6pc的表达水平, 如胰高血糖素可以增加大鼠肝脏中g6pc的mRNA水平, 而胰岛素可以抑制其表达[16-17]。虹鳟[23]和金头鲷[8] g6pc的表达水平也能够被胰岛素抑制。葡萄糖和胰岛素刺激草鱼肝细胞结果表明, 15 mmol/L葡萄糖和1 μmol/L胰岛素共同刺激L8824后, 其对g6pca的刺激作用被胰岛素抑制。但是30 mmol/L葡萄糖对L8824的g6pca mRNA水平无显著性影响, 且胰岛素也无法抑制肝细胞g6pca的表达, 可能是因为培养基中葡萄糖浓度过高导致草鱼肝细胞出现胰岛素抵抗。Ding等[36]也曾用30 mmol/L葡萄糖刺激人肝癌细胞HepG2来构建胰岛素抵抗模型, 发现30 mmol/L葡萄糖能显著降低HepG2的胰岛素信号。
应用多重对比的方法从草鱼基因组数据库中获取了3个g6pc基因的序列, 通过序列比对和系统进化树分析结果, 分别命名为g6pca、g6pcb1和g6pcb2, 且发现3个亚型具有不同的组织表达特异性。此外, 高糖饲料可以使草鱼肝脏g6pca mRNA的表达量升高, 而不影响g6pcb1及g6pcb2的表达水平, 15 mmol/L葡萄糖能够增加L8824 g6pca的表达量, 且1 μmol/L胰岛素可以抑制这种作用。本研究结果表明, 草鱼g6pc发生基因加倍后, 不同亚型之间存在功能差异, 且其在糖代谢中的作用是否与其他鱼类或哺乳动物类似, 还需进一步研究。
| [1] |
Foster J D, Pederson B A, Nordlie R C. Glucose-6-phosphatase structure, regulation and function:An update[J]. Experimental Biology and Medicine, 1997, 215(4): 314-332. DOI:10.3181/00379727-215-44142 |
| [2] |
van de Werve G, Lange A, Newgard C, et al. New lessons in the regulation of glucose metabolism taught by the glucose 6-phosphatase system[J]. European Journal of Biochemistry, 2000, 267(6): 1533-1549. DOI:10.1046/j.1432-1327.2000.01160.x |
| [3] |
Nordlie R C, Foster J D, Lange A J. Regulation of glucose production by the liver[J]. Annual Review of Nutrition, 1999, 19: 379-406. DOI:10.1146/annurev.nutr.19.1.379 |
| [4] |
Shieh J J, Pan C J, Mansfield B C, et al. In islet-specific glucose-6-phosphatase-related protein, the beta cell antigenic sequence that is targeted in diabetes is not responsible for the loss of phosphohydrolase activity[J]. Diabetologia, 2005, 48(9): 1851-1859. DOI:10.1007/s00125-005-1848-6 |
| [5] |
Marandel L, Seiliez I, Véron V, et al. New insights into the nutritional regulation of gluconeogenesis in carnivorous rainbow trout (Oncorhynchus mykiss):A gene duplication trail[J]. Physiological Genomics, 2015, 47(7): 253-263. DOI:10.1152/physiolgenomics.00026.2015 |
| [6] |
Marandel L, Panserat S, Plagnes-Juan E, et al. Evolutionary history of glucose-6-phosphatase encoding genes in vertebrate lineages:towards a better understanding of the functions of multiple duplicates[J]. BMC Genomics, 2017, 18(1): 342. DOI:10.1186/s12864-017-3727-1 |
| [7] |
Caseras A, Metón I, Vives C, et al. Nutritional regulation of glucose-6-phosphatase gene expression in liver of the gilthead sea bream (Sparus aurata)[J]. British Journal of Nutrition, 2002, 88(6): 607-614. DOI:10.1079/BJN2002701 |
| [8] |
Metón I, Caseras A, Fernández F, et al. Molecular cloning of hepatic glucose-6-phosphatase catalytic subunit from gilthead sea bream (Sparus aurata):Response of its mRNA levels and glucokinase expression to refeeding and diet composition[J]. Comparative Biochemistry and Physiology Part B, Biochemistry & Molecular Biology, 2004, 138(2): 145-153. |
| [9] |
Panserat S, Perrin A, Kaushik S. High dietary lipids induce liver glucose-6-phosphatase expression in rainbow trout (Oncorhynchus mykiss)[J]. The Journal of Nutrition, 2002, 132(2): 137-141. DOI:10.1093/jn/132.2.137 |
| [10] |
Panserat S, Médale F, Brèque J, et al. Lack of significant long-term effect of dietary carbohydrates on hepatic glucose-6-phosphatase expression in rainbow trout (Oncorhynchus mykiss)[J]. The Journal of Nutritional Biochemistry, 2000, 11(1): 22-29. DOI:10.1016/S0955-2863(99)00067-4 |
| [11] |
Polakof S, Moon T W, Aguirre P, et al. Glucose homeostasis in rainbow trout fed a high-carbohydrate diet:Metformin and insulin interact in a tissue-dependent manner[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2011, 300(1): R166-R174. DOI:10.1152/ajpregu.00619.2010 |
| [12] |
Song X R, Marandel L, Dupont-Nivet M, et al. Hepatic glucose metabolic responses to digestible dietary carbohydrates in two isogenic lines of rainbow trout[J]. Biology Open, 2018, 7(6): bio032896. DOI:10.1242/bio.032896 |
| [13] |
Qian Y X, Zheng W X, Song J J. Cloning and sequence analysis of Lateolabrax japonicus glucose-6-phosphatase catalytic subunit (G6PC) cDNA and its 5'-flanking region[J]. Journal of Agricultural Biotechnology, 2011, 19(4): 606-615. [钱云霞, 郑伟贤, 宋娟娟. 鲈鱼6-磷酸葡萄糖酶催化亚基(G6PC) cDNA和5'侧翼序列的克隆及分析[J]. 农业生物技术学报, 2011, 19(4): 606-615. DOI:10.3969/j.issn.1674-7968.2011.04.003] |
| [14] |
Wang Y, Wang H, Li M Y, et al. Identification, expression and regulation of amphioxus G6Pase gene with an emphasis on origin of liver[J]. General and Comparative Endocrinology, 2015, 214: 9-16. DOI:10.1016/j.ygcen.2014.12.021 |
| [15] |
Chen Y J, Zhang T Y, Chen H Y, et al. An evaluation of hepatic glucose metabolism at the transcription level for the omnivorous GIFT tilapia, Oreochromis niloticus during postprandial nutritional status transition from anabolism to catabolism[J]. Aquaculture, 2017, 473: 375-382. DOI:10.1016/j.aquaculture.2017.03.009 |
| [16] |
Argaud D, Zhang Q, Pan W, et al. Regulation of rat liver glucose-6-phosphatase gene expression in different nutritional and hormonal states:Gene structure and 5'-flanking sequence[J]. Diabetes, 1996, 45(11): 1563-1571. DOI:10.2337/diab.45.11.1563 |
| [17] |
Dickens M, Svitek C A, Culbert A A, et al. Central role for phosphatidylinositide 3-kinase in the repression of glucose-6-phosphatase gene transcription by insulin[J]. Journal of Biological Chemistry, 1998, 273(32): 20144-20149. DOI:10.1074/jbc.273.32.20144 |
| [18] |
Minassian C, Montano S, Mithieux G. Regulatory role of glucose-6-phosphatase in the repletion of liver glycogen during refeeding in fasted rats[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1999, 1452(2): 172-178. DOI:10.1016/S0167-4889(99)00130-5 |
| [19] |
Morata P, Vargas A M, Sánchez-Medina F, et al. Evolution of gluconeogenic enzyme activities during starvation in liver and kidney of the rainbow trout (Salmo gairdneri)[J]. Comparative Biochemistry and Physiology. Part B:Comparative Biochemistry, 1982, 71(1): 65-70. |
| [20] |
Foster G D, Moon T W. Hypometabolism with fasting in the yellow perch (Perca flavescens):A study of enzymes, hepatocyte metabolism, and tissue size[J]. Physiological Zoology, 1991, 64(1): 259-275. |
| [21] |
Tang Y K, Yu J H, Liu B, et al. Molecular cloning of hepatic glucose-6-phosphatase catalytic subunit from Erythroculter ilishaeform is:Response of its expression to refeeding and carbohydrate in diet[J]. Journal of Fisheries of China, 2007, 31(1): 45-53. [唐永凯, 俞菊华, 刘波, 等. 翘嘴红鲌肝脏G6Pase催化亚基的克隆以及摄食和饲料中碳水化合物对其表达的影响[J]. 水产学报, 2007, 31(1): 46-53.] |
| [22] |
Fang L, Liang X F, Zhou Y, et al. Programming effects of high-carbohydrate feeding of larvae on adult glucose metabolism in zebrafish, Danio rerio[J]. British Journal of Nutrition, 2014, 111(5): 808-818. DOI:10.1017/S0007114513003243 |
| [23] |
Lucie M, Dai W W, Stéphane P, et al. The five glucose-6-phosphatase paralogous genes are differentially regulated by insulin alone or combined with high level of amino acids and/or glucose in trout hepatocytes[J]. Molecular Biology Reports, 2016, 43(4): 207-211. DOI:10.1007/s11033-016-3962-6 |
| [24] |
Marandel L, Véron V, Surget A, et al. Glucose metabolism ontogenesis in rainbow trout (Oncorhynchus mykiss) in the light of the recently sequenced genome:New tools for intermediary metabolism programming[J]. The Journal of Experimental Biology, 2016, 219(5): 734-743. DOI:10.1242/jeb.134304 |
| [25] |
Li A X, Yuan X C, Liang X F, et al. Adaptations of lipid metabolism and food intake in response to low and high fat diets in juvenile grass carp (Ctenopharyngodon idellus)[J]. Aquaculture, 2016, 457: 43-49. DOI:10.1016/j.aquaculture.2016.01.014 |
| [26] |
Li J, Liu L W, Liang X F, et al. Modulation of appetite, lipid and glucose metabolism of juvenile grass carp (Ctenopharyngodon idellus) by different dietary protein levels[J]. Fish Physiology and Biochemistry, 2017, 43(2): 297-307. DOI:10.1007/s10695-016-0287-2 |
| [27] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [28] |
Cai W J, Liang X F, Yuan X C, et al. Genomic organization and expression of insulin receptors in grass carp, Ctenopharyngodon idellus[J]. Comparative Biochemistry and Physiology Part B:Biochemistry & Molecular Biology, 2016, 194-195: 51-57. |
| [29] |
Littlechild J, Garcia-Rodriguez E, Dalby A, et al. Structural and functional comparisons between vanadium haloperoxidase and acid phosphatase enzymes[J]. Journal of Molecular Recognition, 2002, 15(5): 291-296. DOI:10.1002/jmr.590 |
| [30] |
Ishikawa K, Mihara Y, Gondoh K, et al. X-ray structures of a novel acid phosphatase from Escherichia blattae and its complex with the transition-state analog molybdate[J]. The EMBO Journal, 2000, 19(11): 2412-2423. DOI:10.1093/emboj/19.11.2412 |
| [31] |
Ghosh A, Shieh J J, Pan C J, et al. The catalytic center of glucose-6-phosphatase. HIS176 is the nucleophile forming the phosphohistidine-enzyme intermediate during catalysis[J]. Journal of Biological Chemistry, 2002, 277(36): 32837-32842. DOI:10.1074/jbc.M201853200 |
| [32] |
van Schaftingen E, Gerin I. The glucose-6-phosphatase system[J]. Biochemical Journal, 2002, 362(3): 513-532. DOI:10.1042/bj3620513 |
| [33] |
Cherrington A D. Banting lecture 1997. Control of glucose uptake and release by the liver in vivo[J]. Diabetes, 1999, 48(5): 1198-1214. DOI:10.2337/diabetes.48.5.1198 |
| [34] |
Shikata T, Iwanaga S, Shimeno S. Effects of dietary glucose, fructose, and galactose on hepatopancreatic enzyme activities and body composition in carp[J]. Fisheries Science, 1994, 60(5): 613-617. DOI:10.2331/fishsci.60.613 |
| [35] |
Massillon D. Regulation of the glucose-6-phosphatase gene by glucose occurs by transcriptional and post-transcriptional mechanisms. Differential effect of glucose and xylitol[J]. Journal of Biological Chemistry, 2001, 276(6): 4055-4062. DOI:10.1074/jbc.M007939200 |
| [36] |
Ding X Q, Jian T Y, Wu Y X, et al. Ellagic acid ameliorates oxidative stress and insulin resistance in high glucose-treated HepG2 cells via miR-223/keap1-Nrf2 pathway[J]. Biomedicine & Pharmacotherapy, 2019, 110: 85-94. |
 2020, Vol. 27
2020, Vol. 27

