渔业资源增殖放流是修复衰退渔业资源种群、提升渔业产出能力的重要渔业管理手段[1-2]。近年来, 随着中国对渔业资源增殖放流投入力度的不断加大, 增殖放流的功效问题已成为社会关注的热点。到目前为止, 国内增殖放流功效评估领域的研究多集中在以回捕率、投入产出比等为评价指标的经济功效评估上[3-5], 很少涉及增殖群体对水域生态适应性的评估内容。增殖群体生态适应性是对增殖群体生长、摄食、栖息地利用能力等的综合反映, 它不仅是度量增殖放流功效的基础内容, 亦是改进增殖放流苗种繁育和驯化技术的重要依据[6-7]。增殖群体生态适应性现已成为渔业资源增殖放流领域的一项基础研究内容[8-9]。
象山港为地处浙江省中部沿海的一个狭长形半封闭港湾, 是东海近海开展渔业资源增殖放流工作的重点水域。黄姑鱼(Nibea albiflora)为该水域的定居性鱼类, 具有较高的经济价值[10]。近年来, 随着过度捕捞和海洋开发的日益加剧, 黄姑鱼等优质渔业资源种群显著衰退。为修复衰退渔业种群, 促进渔民增产增收, 近年来相关部门在象山港持续开展黄姑鱼的增殖放流工作, 年苗种投放量达数十万尾。为准确掌握增殖群体的生态适应能力, 科学评估增殖放流工作成效, 亟需开展针对增殖群体的生长、摄食、存活状况等的基础性研究。
本研究拟以生长速率、空胃率、胃饱满指数、饵料生物生态位宽度指数、肥满度和肝脏指数等为生态适应性表征参数, 通过分析不同时段黄姑鱼增殖群体的生长状况和摄食特征, 结合其与自然群体相关表征参数的对比, 揭示黄姑鱼增殖群体的生态适应特征, 以丰富对增殖群体生态适应性的理论认知, 并为后续象山港黄姑鱼增殖放流管理决策的制定提供依据。
1 材料与方法 1.1 研究对象本研究以2012年宁波市在象山港放流的黄姑鱼人工繁育个体为研究对象。该年度象山港共计放流人工培育黄姑鱼幼鱼31.5万尾。放流鱼苗的亲体源自象山港黄姑鱼野生个体, 经催产、排卵受精, 于2012年4月上旬孵化出苗; 苗种经2个多月人工暂养, 于2012年6月18日放流至象山港水域。经测定, 黄姑鱼放流鱼苗的体长在83~110 mm, 均值为96.8 mm。
1.2 研究方法本研究以黄姑鱼增殖放流实施后的3个月时段为研究期限, 依托当地生计渔业定期采集象山港黄姑鱼渔获样品, 在科学判读渔获样品属性信息的基础上, 通过分析不同时段黄姑鱼增殖群体的生长状况和摄食特征, 结合其与自然群体相关表征参数的比对, 从摄食和生长两个层面解析黄姑鱼增殖放流群体对自然水体的生态适应特征。
1.2.1 样品采集经调研, 桁杆拖网为象山港水域捕捞黄姑鱼的主要作业方式。在黄姑鱼增殖放流实施前后, 选取3艘桁杆拖网渔船作为监测船只, 进行黄姑鱼渔获样品采集。样品采集时段为6—9月, 期间留存监测船只每月16—18日的所有黄姑鱼渔获样品, 冷冻后带回实验室分析。所采样品经体长、体重、纯体重和肝脏重测定后, 取其矢耳石和胃含物, 分别用以判读其年龄及摄食信息。年龄判读方法参照林楠等[11]的方法。
1.2.2 增殖群体属性判别象山港水域分布有一定数量的黄姑鱼自然种群, 放流鱼苗进入自然水体后将与自然种群混栖。鉴于此, 要开展增殖群体生态适应特征研究, 必须首先建立行之有效的增殖群体和自然群体判别方法。本研究主要利用增殖放流群体与自然种群在繁殖补充时间上的差异, 依据黄姑鱼渔获个体体长与年龄结构信息, 实施增殖群体与自然种群判别。
文献检索发现, 象山港黄姑鱼自然种群和增殖放流鱼苗在繁殖补充时间上存在明显差异。黄姑鱼增殖放流鱼苗于4月上旬孵化, 经两个多月人工养殖条件下的快速生长发育, 至实施放流时体长已近100 mm, 放流后即可被桁杆拖网渔业利用; 而象山港黄姑鱼自然种群的繁殖盛期为6—7月[11], 较放流鱼苗孵化时间延迟2~3个月。依据黄姑鱼生长方程估算[12], 在自然水体中黄姑鱼鱼苗需经4~5个月发育, 到每年秋末体长方能增长至80 mm (小于增殖群体放流时的最小体长)。据此可推断, 在7—9月中旬调查期间, 当年出生的野生黄姑鱼个体尚小, 体长80 mm以上黄姑鱼鱼苗应源自增殖放流。
1.2.3 数据处理与分析本研究以特定生长速率[13]、空胃率、胃饱满指数、饵料生物生态位宽度指数[14]、肝脏指数和肥满度[15]等作为生长状况和摄食能力的表征参数, 通过分析不同时段黄姑鱼增殖群体的生长速率、摄食能力和体征状况, 同时结合其与自然群体(本文自然群体特指在研究期间捕获的1龄黄姑鱼个体, 其可能部分源自上一年度放流的黄姑鱼人工繁育鱼苗, 但鉴于此部分增殖放流个体已经过1年生态适应过程, 本文视同为黄姑鱼自然群体)相关表征参数的对比, 探究黄姑鱼增殖群体对自然水域的生态适应。本研究所涉参数指标的计算公式如下:
(1) 特定生长速率(SGR, 单位: %/d):
| $ {\rm{SGR}} = 100(\ln {L_t} - \ln {L_0})/t $ |
式中, L0和Lt分别表征研究起始点的体长(mm)和距起始点t天后的体长(mm)。
(2) 空胃率(PES, 单位: %):
| $ {\rm{PES}} = ({N_{\rm{e}}}/{N_{\rm{t}}}) \times 100 $ |
式中, Ne和Nt分别为空胃个体数和样本总数。
(3) 胃饱满指数(SFI, 单位: %):
| $ {\rm{SFI}} = ({W_{\rm{S}}}/{W_{\rm{b}}}) \times 100 $ |
式中, WS和Wb分别为食物团重量(g)和鱼体纯体质量(g)。
(4) 饵料生物生态位宽度指数(B):
式中, Pi为第i种饵料生物在胃含物中的个数占比。
(5) 肥满度(CF, 单位: %):
式中, W为鱼体重(g), L为鱼体长(cm)。
(6) 肝脏指数(HSI, 单位: %):
| $ {\rm{HSI}} = ({W_{\rm{h}}}/{W_{\rm{b}}}) \times 100 $ |
式中, Wh和Wb分别为肝脏重(g)和鱼体纯体质量(g)。
本研究利用Excel 2010软件中的单因素方差分析(one way ANOVA)对不同调查时段参数指标的差异进行统计学检验。
2 结果与分析 2.1 生长速率黄姑鱼放流结束3个月内, 在象山港海域采集黄姑鱼当龄和1龄样本共计255尾, 各月份所采集黄姑鱼样本的数量、体长和年龄结构信息如图 1所示。期间, 所采集黄姑鱼当龄个体的最小体长为84.6 mm。依本文材料与方法章节中所述的相关标准判断, 该时段所采集的黄姑鱼当龄个体应全部源自当年放流的黄姑鱼人工繁育个体。
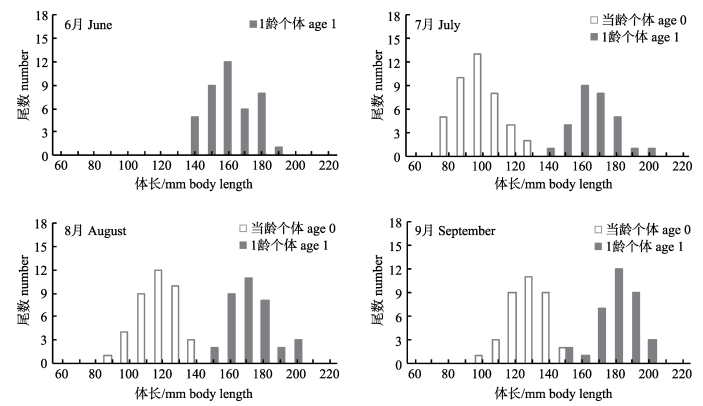
|
图 1 象山港黄姑鱼体长频率分布及年龄结构 Fig.1 Body length frequency distribution and age structure of Nibea albiflora in the Xiangshan Bay |
7月、8月和9月调查取样时段, 黄姑鱼增殖群体的平均体长(x±SD)分别为(99.2±13.8) mm、(118.3±11.9) mm和(128.7±13.5) mm; 同期, 黄姑鱼自然群体的平均体长分别为(166.4±11.8) mm、(173.5±14.8) mm和(179.9±12.9) mm (图 1)。据此估算, 增殖放流后第1、2和3个月, 黄姑鱼增殖群体的特定生长率分别为0.079%/d、0.58%/d和0.28%/d; 同期, 自然群体的特定生长率分别为0.12%/d、0.14 %/d和0.12%/d。
2.2 摄食成功率和饵料生物组成空胃率和胃饱满指数是衡量鱼体摄食成功率的重要参数指标, 空胃率高以及胃饱满指数低通常表征鱼体摄食成功率较低, 摄食能力偏弱。7月、8月和9月调查取样期间, 黄姑鱼增殖群体的空胃率分别为80.95%、46.15%和42.86%;同期, 自然群体的空胃率分别为44.74%、38.24%和41.18% (表 1)。7月、8月和9月黄姑鱼增殖群体的胃饱满指数分别为0.19%、1.04%和0.89%, 单因素方差分析结果显示, 不同月份间增殖群体胃饱满指数存在显著性差异(P < 0.05)。同期, 自然群体胃饱满指数的月份间差异并未达到显著性水平(P > 0.05), 胃饱满指数在0.86%~1.06%范围内波动。总体上看, 增殖放流初期, 黄姑鱼增殖群体的空胃率高于自然群体, 而胃饱满指数明显低于自然群体; 但随时间推移, 两者逐渐趋同。
|
|
表 1 象山港黄姑鱼增殖群体与自然群体空胃率、胃饱满指数和饵料生物生态位宽度指数 Tab.1 Percentages of empty stomachs, stomach fullness and index of dietary niche breadth for wild and enhancement and releasing population of Nibea albiflora in the Xiangshan Bay |
本研究共计鉴定黄姑鱼饵料生物种类14种(包括:虾类10种、蟹类1种、口足类2种、鱼类1种), 其中, 巨指长臂虾和中华管鞭虾等小型虾类是象山港黄姑鱼的优势饵料生物(表 2)。总体上看, 黄姑鱼自然群体所能利用的饵料生物种类数明显高于增殖群体, 日本蟳、黑斑口虾蛄和矛尾虾虎鱼等种类仅作为自然群体的饵料生物出现。从时序上看, 黄姑鱼增殖群体在放流初期所能利用的饵料生物种类较为单一, 7月其饵料生物生态位宽度指数为1.55, 仅为同期自然群体的63.0%;随时间推移, 增殖群体所能利用的饵料生物种类逐渐扩展, 8月和9月其饵料生物生态位宽度指数分别增至2.16和2.13, 与同期自然群体饵料生物生态位宽度指数的差距明显缩小(表 1)。
|
|
表 2 象山港黄姑鱼增殖群体和自然群体饵料生物及其出现频率 Tab.2 Prey items and their frequency of occurrence in wild and enhancement and releasing population of Nibea albiflora in the Xiangshan Bay |
肥满度和肝脏指数是反映鱼体体征和能量储备状况的重要指标。研究期间, 黄姑鱼自然群体的肥满度和肝脏指数保持相对稳定。6月、7月、8月和9月自然群体肝脏指数均值分别为0.96%、0.90%、0.97%和0.92%;同期, 肥满度指数分别为1.82%、1.85%、1.82%和1.80%。单因素方差分析结果显示, 自然群体肝脏指数和肥满度指数均不存在显著性月份差异(肝脏指数: P > 0.05;肥满度: P > 0.05)。
不同月份间增殖群体肝脏指数存在显著性差异(P < 0.05)。放流初期, 增殖群体的肝脏指数显著降低, 其均值由放流前的0.96%降至7月调查取样时的0.77%;随后, 逐渐恢复并保持在放流前水平(图 2)。同期, 增殖群体肥满度的月份间差异并未达到显著性水平(P > 0.05), 肥满度指数在1.71%~1.73%范围内波动。
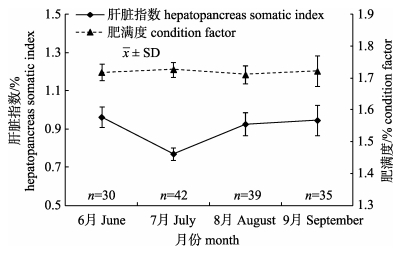
|
图 2 象山港黄姑鱼增殖群体的肝脏指数和肥满度 Fig.2 Hepatopancreas somatic index and condition factor of enhancement and releasing population of Nibea albiflora in the Xiangshan Bay |
人工繁育的放流群体对自然水体生态适应能力的高低是影响放流苗种存活率、制约放流效能发挥的重要因素。摄食能力和生长速率作为表征增殖群体生态适应性的基础参数, 一直是增殖群体生态适应性研究的热点。本研究利用放流后3个月内的现场监测资料, 从摄食和生长两个层面分析了象山港黄姑鱼增殖群体的生态适应特征, 初步阐明了放流初期象山港黄姑鱼群体的生态适应过程。
象山港黄姑鱼的生态适应过程可大致分为以下两个阶段。首先, 放流后最初1个月, 体长增长缓慢, 摄食能力明显偏弱, 对自然水体的生态适应能力明显偏低。具体表现为: (1)生长速率极低, 特定生长速率仅为0.079%/d, 生长基本处于停滞状态; (2)增殖群体空胃率极高(表 1), 且饵料生物组成相对单一, 仅能捕食巨指长臂虾和疣背宽额虾等小型虾类, 增殖群体面临较为严重的饥饿胁迫。与此同时, 值得关注的是, 该时期增殖群体的肝脏指数较增殖放流前大幅下降(图 2)。究其原因, 这可能与饥饿胁迫下增殖个体大量消耗其肝脏储能用以维持鱼体正常生理活动有关。大量研究表明, 在饥饿胁迫下, 鱼类通常会动用身体器官中糖类、脂肪和蛋白质等储能物质来维持各项生理活动[16]。鱼类动用不同器官储能物质具有一定先后次序, 通常首先利用储存性组织的储能, 然后才会利用重要器官和运动系统中的结构物质[17]。肝脏是鱼体中重要的储能场所, 在饥饿状态下, 大多数鱼类通常会首先消耗肝脏内的储存物质用以维持鱼体生理活动[18]。鉴于上述, 黄姑鱼增殖群体肝脏指数的下降可理解为面对增殖放流初期饥饿胁迫的一种应急性反应。
随时间推移, 黄姑鱼增殖群体摄食成功率和饵料生物生态位宽度指数与自然群体的差距大幅缩小, 摄食能力明显增强, 肝脏指数亦基本恢复至放流前水准。该时期黄姑鱼增殖群体摄食能力的提升可能与以下两个因素相关。首先, 经一段时间的适应, 黄姑鱼增殖群体对自然水体饵料环境的适应性逐渐增强, 主动摄食能力得以锻炼, 摄食成功率明显提升, 饵料生物利用范围得以拓展。其次, 经一段时间的自然环境筛选, 黄姑鱼增殖群体中生态适应能力偏低的部分个体可能已被淘汰, 间接促使黄姑鱼增殖群体整体表现出的摄食能力有所提升。伴随摄食能力的增强, 黄姑鱼增殖群体的生长速度较前一时期明显加快, 放流结束1~2个月和2~3个月黄姑鱼增殖群体的特定生长速率分别达到0.58%/d和0.28%/d, 与放流结束第1个月相比, 分别提升约6.9倍和2.5倍; 同时亦明显高于同期自然群体的生长速率。基于上述黄姑鱼增殖群体特定生长速率的变化情况, 同时结合自然群体的生长特性综合分析发现, 象山港黄姑鱼增殖群体在经历一段饥饿胁迫, 主动摄食能力得以改善后, 其生长状况呈现出一定的补偿性生长特征。鱼类的补偿性生长是指鱼体经一段时间饥饿或营养不足, 恢复正常摄食后, 在一定时期内出现高于正常生长速度的快速增长现象[19]。有研究表明, 补偿性生长对鱼体具有一些积极的生态学意义[20]。在自然水体中, 鱼体的自然死亡率通常与其个体大小负相关[21]。补偿性生长引发的鱼体快速发育有助于其抗应激性、逃避敌害能力的迅速提升, 进而有效降低其自然死亡率[22-23]。从上述角度分析, 黄姑鱼增殖群体补偿性生长现象的发生将有助于提升其增殖放流功效。
综上所述, 增殖放流初期象山港黄姑鱼增殖群体呈现出相对较弱的生态适应能力, 该结果符合目前学界对于增殖群体生态适应特征的一般认知[24-25]。近年来, 伴随该领域研究的不断深入, 人们逐渐尝试开展增殖群体生态适合性影响机制研究, 现已从增殖苗种遗传变异、苗种人工培育密度、高脂高糖饲料喂养、过度投饵、缺乏天然饵料, 觅食训练和养殖水体环境单一等多个角度进行了探索[26-28]。现阶段, 中国同类研究开展仍相对滞后, 建议今后以本研究发现为切入点, 结合黄姑鱼增殖放流苗种培育工作实际, 积极开展增殖群体生态适应性影响机制研究, 以为后续优化增殖放流苗种人工繁育过程、提升渔业资源增殖放流功效提供依据。
| [1] |
Molony B W, Lenanton R, Jackson G, et al. Stock enhancement as a fisheries management tool[J]. Reviews in Fish Biology and Fisheries, 2003, 13(4): 409-432. DOI:10.1007/s11160-004-1886-z |
| [2] |
Bartley D M, Bell J D. Restocking, stock enhancement, and sea ranching: Arenas of progress[J]. Reviews in Fisheries Science, 2008, 16(1-3): 357-365. DOI:10.1080/10641260701678058 |
| [3] |
Wang Q Y, Zhuang Z M, Deng J Y, et al. Stock enhancement and translocation of the shrimp Penaeus chinensis in China[J]. Fisheries Research, 2006, 80: 67-79. DOI:10.1016/j.fishres.2006.03.015 |
| [4] |
Liang J, Wang W D, Lin G Z, et al. Effect and assessment of enhancement release of Nibea japonica and Sparus microcephalus in artificial reef habitat waters of Zhoushan, Zhejiang[J]. Journal of Fishery Sciences of China, 2010, 17(5): 1075-1084. [梁君, 王伟定, 林桂装, 等. 浙江舟山人工生境水域日本黄姑鱼和黑鲷的增殖放流效果及评估[J]. 中国水产科学, 2010, 17(5): 1075-1084.] |
| [5] |
Chen P, Qin C, Yu J, et al. Evaluation of the effect of stock enhancement in the coastal waters of Guangdong, China[J]. Fisheries Management and Ecology, 2015, 22(2): 172-180. DOI:10.1111/fme.12113 |
| [6] |
Brown C, Day R L. The future of stock enhancements: Lessons for hatchery practice from conservation biology[J]. Fish and Fisheries, 2002, 3(2): 79-94. DOI:10.1046/j.1467-2979.2002.00077.x |
| [7] |
Liao I, Su M S, Leaño E M. Status of research in stock enhancement and sea ranching[J]. Reviews in Fish Biology and Fisheries, 2003, 13(2): 151-163. DOI:10.1023/B:RFBF.0000019477.97551.73 |
| [8] |
Munakata A, Björnsson B T, Jönsson E, et al. Post-release adaptation processes of hatchery-reared honmasu salmon parr[J]. Journal of Fish Biology, 2000, 56(1): 163-172. DOI:10.1111/j.1095-8649.2000.tb02092.x |
| [9] |
Tomiyama T, Watanabe M, Kawata G, et al. Post-release feeding and growth of hatchery-reared Japanese flounder Paralichthys olivaceus: Relevance to stocking effectiveness[J]. Journal of Fish Biology, 2011, 78(5): 1423-1436. DOI:10.1111/j.1095-8649.2011.02949.x |
| [10] |
Jiang Y Z, Lin N, Yuan X W, et al. Community structure and species diversity of nektons in Xiangshan Bay of East China[J]. Chinese Journal of Ecology, 2013, 32(4): 920-926. [姜亚洲, 林楠, 袁兴伟, 等. 象山港游泳动物群落结构及多样性[J]. 生态学杂志, 2013, 32(4): 920-926.] |
| [11] |
Lin N, Jiang Y Z, Yuan X W, et al. Reproductive biology of Nibea albiflora in Xiangshan Bay[J]. Marine Fisheries, 2013, 35(4): 389-395. [林楠, 姜亚洲, 袁兴伟, 等. 象山港黄姑鱼的繁殖生物学[J]. 海洋渔业, 2013, 35(4): 389-395. DOI:10.3969/j.issn.1004-2490.2013.04.003] |
| [12] |
Wu C W, Zhao S J, Hu C C. Age and growth of Nibea albiflora in the East China Sea[J]. Marine Fisheries, 2005, 27(3): 193-199. [吴常文, 赵淑江, 胡春春. 东海黄姑鱼年龄与生长的初步研究[J]. 海洋渔业, 2005, 27(3): 193-199. DOI:10.3969/j.issn.1004-2490.2005.03.004] |
| [13] |
Zhou Y, Yang H S, Hu H Y, et al. Bioremediation potential of the macroalga Gracilaria lemaneiformis (Rhodophyta) integrated into fed fish culture in coastal waters of North China[J]. Aquaculture, 2006, 252(2-4): 264-276. DOI:10.1016/j.aquaculture.2005.06.046 |
| [14] |
Costa G C. Predator size, prey size, and dietary niche breadth relationships in marine predators[J]. Ecology, 2009, 90(7): 2014-2019. DOI:10.1890/08-1150.1 |
| [15] |
Caballero M J, Obach A, Rosenlund G, et al. Impact of different dietary lipid sources on growth, lipid digestibility, tissue fatty acid composition and histology of rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 2002, 214(1-4): 253-271. DOI:10.1016/S0044-8486(01)00852-3 |
| [16] |
Xie X J, Deng L, Zhang B. Advances and studies on ecophysiological effects of starvation on fish[J]. Acta Hydrobiologica Sinica, 1998, 22(2): 181-188. [谢小军, 邓利, 张波. 饥饿对鱼类生理生态学影响的研究进展[J]. 水生生物学报, 1998, 22(2): 181-188. DOI:10.3321/j.issn:1000-3207.1998.02.014] |
| [17] |
Collins A L, Anderson T A. The regulation of endogeneous energy stores during starvation and refeeding in the somatic tissues of the golden perch[J]. Journal of Fish Biology, 1995, 47(6): 1004-1015. DOI:10.1111/j.1095-8649.1995.tb06024.x |
| [18] |
Wang T, Liu L P, Chen T Y, et al. Variations of biological indicators and protein and amino acid content in Anguilla japonica during gonad development and starvation stress[J]. Oceanologia et Limnologia Sinica, 2015, 46(6): 1373-1379. [王婷, 刘利平, 陈桃英, 等. 鳗鲡(Anguilla japonica)性腺发育和饥饿胁迫下生物学指标及体内蛋白质与氨基酸含量变化[J]. 海洋与湖沼, 2015, 46(6): 1373-1379.] |
| [19] |
Skalski G T, Picha M E, Gilliam J F, et al. Variable intake, compensatory growth, and increased growth efficiency in fish: Models and mechanisms[J]. Ecology, 2005, 86(6): 1452-1462. DOI:10.1890/04-0896 |
| [20] |
Ali M, Nicieza A, Wootton R J. Compensatory growth in fishes: A response to growth depression[J]. Fish and Fisheries, 2003, 4(2): 147-190. DOI:10.1046/j.1467-2979.2003.00120.x |
| [21] |
Sogard S M. Size-selective mortality in the juvenile stage of teleost fishes: A review[J]. Bulletin of Marine Science, 1997, 60: 1129-1157. |
| [22] |
Johnsson J I. Big and brave: Size selection affects foraging under risk of predation in juvenile rainbow trout, Oncorhynchus mykiss[J]. Animal Behaviour, 1993, 45(6): 1219-1225. DOI:10.1006/anbe.1993.1143 |
| [23] |
Schultz E T, Conover D O. The allometry of energy reserve depletion: Test of a mechanism for size-dependent winter mortality[J]. Oecologia, 1999, 119: 474-483. DOI:10.1007/s004420050810 |
| [24] |
Araki H, Berejikian B A, Ford M J, et al. SYNTHESIS: Fitness of hatchery-reared salmonids in the wild[J]. Evolutionary Applications, 2008, 1(2): 342-355. |
| [25] |
Araki H, Schmid C. Is hatchery stocking a help or harm? Evidence, limitations and future directions in ecological and genetic surveys[J]. Aquaculture, 2010, 308(S1): 2-11. |
| [26] |
Seddon P J, Armstrong D P, Maloney R F. Developing the science of reintroduction biology[J]. Conservation Biology, 2007, 21(2): 303-312. |
| [27] |
Madison B N, Heath J W, Heath D D, et al. Effect of parental mate choice and semi-natural early rearing environment on the growth performance and seawater tolerance of Chinook salmon Oncorhynchus tshawytscha[J]. Journal of Fish Biology, 2013, 82(2): 618-636. DOI:10.1111/jfb.12018 |
| [28] |
Jonsson B, Jonsson N. Early environment influences later performance in fishes[J]. Journal of Fish Biology, 2014, 85(2): 151-188. DOI:10.1111/jfb.12432 |
 2020, Vol. 27
2020, Vol. 27

