2. 湖南农业大学中兽药湖南省重点实验室, 湖南 长沙 410128
2. Hunan Key Laboratory of Traditional Chinese Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China
黄鳝(Monopterus albus)是中国重要的淡水名特养殖品种之一, 目前其产量已接近40万t[1]。随着黄鳝养殖规模的逐步扩大和集约化程度的不断提高, 以及饲料原料的不合理使用, 鱼体免疫力降低和肠道损伤问题不断出现[2]。虽然抗生素具有抗菌作用, 但因其滥用会导致细菌耐药性、药物残留及水环境污染等问题, 从而在水产养殖中被限用或禁用[3-4]。近年来, 关于中草药及天然植物提取物提高水产动物生长、增强免疫力及抗炎等作用的研究被相继报道[5-6]。血根碱(sanguinarine)是湖南农业大学中兽药湖南省重点实验室开发的绿色添加剂, 已开发注册为二类新中兽药[(2011)新兽药证字34号)], 是一种苯菲啶异喹啉类生物碱, 主要存在于博落回、白屈菜和血水草中[7-8], 其化学活性基于其亚胺基团的亲核性, 可参与氧化剂清除和氧化酶抑制[9]。在畜禽中已有大量研究, 如在断奶仔猪中, 血根碱能够提高血清免疫球蛋白G(IgG)含量和溶菌酶(LSZ)活性, 提高吞噬细胞吞噬指数、改善免疫功能、增强抗病力, 进而改善生长性能[10]; 在白羽肉鸡的研究中, 血根碱能够增强免疫力, 改善肠道健康等[11]。但目前有关血根碱在水产动物中是否具有缓解机体免疫应激作用尚未见相关报道。
脂多糖(LPS)是一种革兰氏阴性菌抗原, 当其与细胞膜上相应受体作用后, 启动胞内信号传递链, 引起核因子-κB(NF-κB)等活化, 启动基因转录、表达和释放多种细胞因子, 诱导促炎基因的转录从而引发炎症反应[12]。有研究报道, 在草鱼(Ctenopharyngodon idella)[13]、虹鳟(Oncorhynchus mykiss)[14]和斑点叉尾鮰(Ictalurus punctatus)[15]腹腔中注射LPS能够诱导肿瘤坏死因子-α(TNF-α)等炎症因子的表达, 从而使得鱼体产生炎症反应。本实验通过探讨血根碱是否具有缓解LPS诱导后黄鳝免疫应激及肠道炎症反应的作用, 旨在为血根碱在水产饲料中的应用提供科学依据。
1 材料与方法 1.1 实验材料血根碱由中兽药湖南省重点实验室提供, 纯度≥98%;大肠杆菌脂多糖(LPS, Escherichia coli O55:B5)购于美国Sigma Chemical Co.。
1.2 实验饲料以黄鳝商品饲料配方为基础, 配制出一种以鱼粉、豆粕、玉米蛋白粉和大豆浓缩蛋白为蛋白源, 鱼油为脂肪源的基础饲料, 实验饲料组成及营养水平见表 1。本课题组前期预实验中发现, 添加750 μg/kg血根碱能促进鱼体生长、提高免疫力, 因此本研究配置对照组(基础饲料)和实验组(基础饲料+750 μg/kg血根碱)2组试验饲料。饲料原料经先粉碎过60目筛网, 再按配比从小到大逐级定量均匀混合, 再将其进入V型搅拌机充分混合25 min, 随后将鱼油与已混好的干粉充分混匀, 饲料风干后置于‒20℃冰箱中保存备用, 投喂前加20%水调成面团状使用。
|
|
表 1 基础饲料组成及营养水平(风干基础) Tab.1 Composition and nutrient levels of basic diet (air-dry basis) |
养殖实验在湖南省常德市黄鳝实验基地池塘网箱(1.5 m×1.5 m×2.0 m)中进行, 挑选健康、规格整齐的黄鳝, 放入网箱后停食48 h, 用蚯蚓和鱼浆进行前期驯化, 驯养到能够正常摄食鱼浆后, 投喂饲料与鱼浆混合物(比例1:4), 根据摄食情况提高饲料的比例, 直至黄鳝完全摄食饲料, 整个驯化时间约为15 d, 停食24 h后, 挑选初始体重为(28.00±0.03) g的黄鳝随机分成2组, 每组3个重复, 共6个网箱(1.5 m×2.0 m×1.0 m), 每个网箱饲养50尾黄鳝。日投喂1次(17:00—18:00), 投喂量为黄鳝初始体重的3%~5%(饲料为湿重), 每星期调整1次投喂量, 养殖时间持续8周。
1.4 样品采集养殖8周后, 禁食24 h, 每个网箱取30尾鱼进行腹腔注射10 mg/kg LPS (预实验确定LPS浓度:不同浓度LPS进行注射, 观察48 h内黄鳝活跃或死亡情况), 分别在注射前0 h和注射后3 h、6 h、12 h、24 h和48 h尾静脉采血, 在注射和采样前, 使用MS-222进行麻醉, 减少注射和采样所引起的应激。每个网箱每个时间节点采集5尾鱼, 用2 mL注射器尾静脉取血, 将血液混合并置于无菌离心管中, 4℃静置过夜, 3000 r/min离心10 min, 取上层血清置于‒80℃冰箱保存备用; 取鱼体肝脏保存于‒80℃冰箱备用; 取鱼体肠道组织于1.5 mL无RNA酶管中, 封口膜封口后置于液氮中, ‒80℃保存备用。
1.5 饲料营养成分测定饲料常规营养成分测定参照AOAC的方法[16]。将其中水分用105℃烘箱干燥恒重法烘干, 粗蛋白的测定采用凯氏定氮法, 粗脂肪的测定采取索氏抽提法, 粗灰分的测定采用550℃灼烧法。
1.6 酶活性指标测定黄鳝血清中的葡萄糖(GLU)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)、碱性磷酸酶(AKP)和肝脏中超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)按照南京建成生物工程研究所试剂盒的要求进行检测; 血清中免疫球蛋白M(IgM)、补体3(C3)、补体4(C4)指标按照浙江伊利康生物技术有限公司试剂盒的要求进行检测; 血清中皮质醇(COR)按照Elisa鱼类试剂盒(上海酶联生物科技有限公司)的要求进行检测。
1.7 肠道相关基因表达量分析 1.7.1 肠道组织中总RNA提取在无酶匀浆管中加入1 mL Trizol试剂, 取‒80℃冻存的肠道组织30~50 mg, 用匀浆仪进行匀浆处理, 匀浆完室温放置5 min, 使其充分裂解; 将裂解好的样品12000 r/min, 4℃离心10 min; 取上清液于新的1.5 mL离心管中, 加入200 μL氯仿, 充分振荡, 冰上静置10 min; 将样品12000 r/min, 4℃离心10 min; 吸取上层水相到新的1.5 mL离心管中, 加入等体积异丙醇, 小心混匀, 于‒20℃放置1 h后, 样品12000 r/min, 4℃离心10 min; 弃上清液, 加入1 mL 75%乙醇, 并小心振荡, 洗涤沉淀, 然后8000 r/min, 4℃离心10 min; 弃75%乙醇, 并重复上步骤; 弃75%乙醇, 干燥, 使管内酒精充分挥发; 用20 μL DEPC·H2O溶解沉淀, 于‒80℃存备用。
1.7.2 cDNA的合成应用PrimeScriptⓇRT re- agent Kit with gDNA Eraser试剂盒进行cDNA合成。基因组DNA的除去反应, 反应体系10 μL (5×gDNA Eraser Buffer 2 μL, gDNA Eraser 1 μL, 模板RNA 1 μL, RNase Freed H2O 6 μL), 42℃孵育2 min; 反转录反应, 反应体系20 μL (5× PrimeScriptⓇBuffer 24 μL, PrimeSycriptⓇRT Enzyme Mix1 1 μL, RT Primer Mix 1 μL, 反应液10 μL, RNase Freed H2O 4 μL), 37℃孵育15 min, 85℃加热5 s合成cDNA模板。
1.7.3 实时荧光定量PCR分析基因表达黄鳝肠道内参基因RPL-17、白介素-1β (IL-1β)、白介素-10 (IL-10)、白介素-12β (IL-12β)、白介素-15 (IL-15)、生长转化因子-β1 (TGF-β1)、生长转化因子-β2 (TGF-β2)和生长转化因子-β3 (TGF-β3)引物序列见表 2, 通过查找NCBI上的基因序列, 并用Primer Premier 5软件设计引物, 引物均由上海生工有限公司合成。Real Time PCR反应体系12.5 μL (SYBR 6 μL, Forward primer 0.5 μL, Reverse primer 0.5 μL, cDNA 0.5 μL, RNase Freed H2O 5 μL), 95℃预变性30 s, 95℃变性5 s, 55℃退火25 s, 72℃延伸15 s, 40个循环, 70~95℃收集数据60 s。运用表达量E=2−ΔΔCT方法进行计算, 其中ΔΔCT=(CT目的基因‒CT内参基因)实验组‒(CT目的基因‒CT内参基因)对照组[17]。
|
|
表 2 本研究所用引物序列 Tab.2 Primer sequences used in the study |
本实验结果先利用Excel 2013进行数据统计, 使用SPSS 19.0统计软件做单因素方差(one-way, ANOVA)分析和t-检验, 并用Duncan多重比较法进行差异性显著性分析, 显著水平为P < 0.05。所有实验数据均用Excel 2013做柱状图与折线图表示。
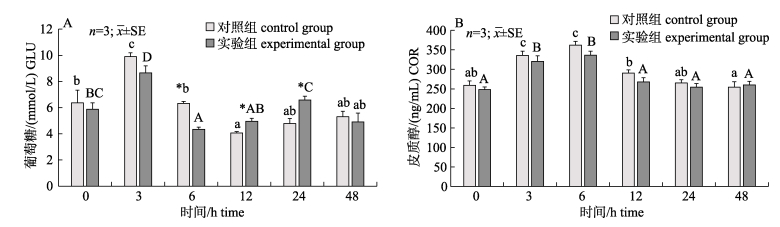
2 结果与分析 2.1 血根碱对脂多糖诱导后黄鳝血清葡萄糖和皮质醇含量的影响由图 1可知, 在0 h时, 对照组和实验组血清中GLU和COR的含量无显著差异(P > 0.05);注射LPS后, 对照组中GLU和COR的含量随时间呈先上升后下降的趋势, 在3 h和6 h显著升高(P < 0.05);与对照组相比, 实验组变化趋势与其一致, 但GLU和COR的含量上升幅度小, 并且恢复至正常水平速度更快, 在6 h时GLU显著低于对照组(P < 0.05)。
|
图 1 血根碱对脂多糖诱导后对黄鳝血清葡萄糖(A)和皮质醇(B)的影响 不同小写字母与大写字母分别表示对照组和实验组在注射LPS后不同时间差异显著(P < 0.05).图中*表示对照组与实验组在同时间节点差异显著(P < 0.05) Fig.1 Effect of sanguinarine on serum glucose (A) and cortisol (B) of Monopterus albus induced by LPS Different small letters and capital letters show significant difference at different times after LPS injection (P < 0.05) in the control group and the experimental group, respectively. * indicates significant difference between the control group and the experimental group at the same time point (P < 0.05) |
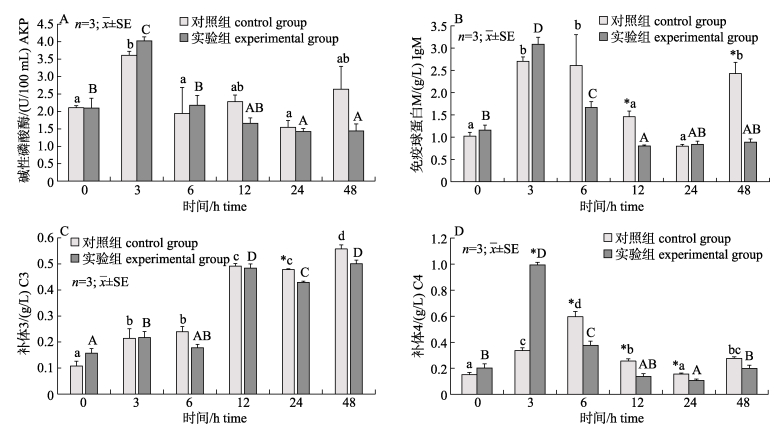
在0 h时, 与对照组相比, 实验组血清中IgM、C3和C4的含量升高, 且C4显著升高(P < 0.05);注射LPS后, 对照组血清中AKP、IgM和C4的含量随时间呈先上升后下降的趋势(P < 0.05), 在3~6 h达到峰值, 且在12 h之后恢复至注射前水平, 而C3含量呈一直上升的趋势; 与对照组相比, 实验组变化趋势与其一致, 但在添加血根碱组AKP、IgM和C4的上升幅度更大, 且在3 h时, C4显著高于对照组(P < 0.05), 以及实验组恢复至正常水平所需时间更短, 并且C4和IgM含量分别在6~24 h和12 h时显著低于对照组(P < 0.05, 图 2)。
|
图 2 血根碱对脂多糖诱导后对黄鳝血清碱性磷酸酶(A)、IgM(B)、C3(C)和C4(D)的影响 不同小写字母与大写字母分别表示对照组和实验组在注射LPS后不同时间差异显著(P < 0.05).图中*表示对照组与实验组在同时间节点差异显著(P < 0.05). Fig.2 Effect of sanguinarine on the serum AKP(A), IgM(B), C3(C) and C4(D) of Monopterus albus induced by LPS Different small letters and capital letters in the figure show significant difference at different times after LPS injection (P < 0.05) in the control and the experimental group, respectively. * indicates significant difference between the control group and the experimental group at the same time (P < 0.05). |
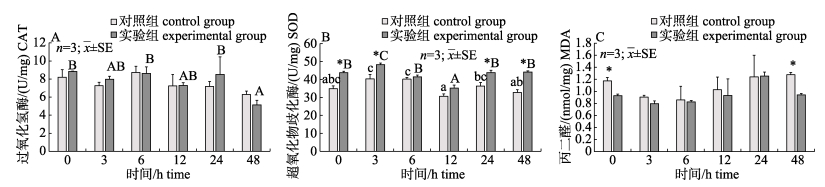
根据图 3可知, 在0 h时, 实验组黄鳝肝脏中SOD含量显著高于对照组(P < 0.05), MDA含量与其相反; 注射LPS后, 对照组肝脏中CAT和MDA活性没有显著影响(P > 0.05), SOD活性随时间呈先升高后降低的趋势, 在3 h时达到峰值; 投喂血根碱组与对照组变化趋势一致, 与对照组相比, 实验组在3 h、24 h和48 h时SOD活性显著升高(P < 0.05), 在48 h时MDA活性显著降低(P < 0.05)。
|
图 3 血根碱对脂多糖诱导后对黄鳝肝脏CAT活性(A)、SOD活性(B)和MDA含量(C)的影响 不同小写字母与大写字母分别表示对照组和实验组在注射LPS后不同时间差异显著(P < 0.05).图中*表示对照组与实验组在同时间节点差异显著(P < 0.05). Fig.3 Effect of sanguinarine on the liver CAT activity(A), SOD activity(B) and MDA content(C) of Monopterus albus induced by LPS Different small letters and capital letters in the figure show significant difference at different times after LPS injection (P < 0.05) in the control and the experimental group, respectively. * indicates significant difference between the control group and the experimental group at the same time (P < 0.05). |
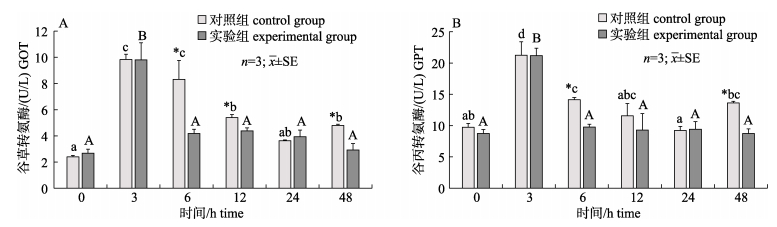
在0 h时, 对照组与实验组血清中GOT和GPT活性没有显著性差异(P > 0.05);注射LPS后, 血清中GOT和GPT活性随时间呈先升高后降低的趋势(P < 0.05), 在3 h达到峰值, 在24 h恢复到0 h水平; 实验组与对照组变化趋势一致, 但所需恢复时间短, 并且GOT和GPT活性分别在6 h、12 h、48 h和6 h、48 h显著低于对照组(P < 0.05, 图 4)。
|
图 4 血根碱对脂多糖诱导后对黄鳝血清GOT(A)和GPT(B)的影响 不同小写字母与大写字母分别表示对照组和实验组在注射LPS后不同时间差异显著(P < 0.05).*表示对照组与实验组在同时间节点差异显著(P < 0.05). Fig.4 Effect of sanguinarine on the serum GOT(A) and GPT(B) of Monopterus albus induced by LPS Different small letters and capital letters in the figure show significant difference at different times after LPS injection (P < 0.05) in the control and the experimental group, respectively. * indicates significant difference between the control group and the experimental group at the same time (P < 0.05). |
使用实时荧光定量RT-PCR方法测定对照组与实验组在LPS攻毒后黄鳝肠道白细胞介素部分基因相对表达量的变化见图 5。在0 h时, 实验组黄鳝肠道IL-10和IL-15基因相对表达量显著高于对照组(P < 0.05), IL-1β基因相对表达量与其相反; 注射LPS后, 肠道IL-1β、IL-10、IL-12β和IL-15基因相对表达量随时间呈先上升后下降的趋势, IL-1β和IL-12β基因相对表达量在3 h和6 h显著升高(P < 0.05), IL-10基因相对表达量在3 h、6 h和12 h显著升高(P < 0.05);实验组与对照组变化趋势一致, 但IL-1β和IL-12β基因相对表达量在3 h、6 h、12 h和24 h时显著低于对照组(P < 0.05), 以及IL-10和IL-15基因相对表达量上升速度高于对照组, 且IL-10基因相对表达量在6 h、12 h和24 h时显著高于对照组(P < 0.05)。
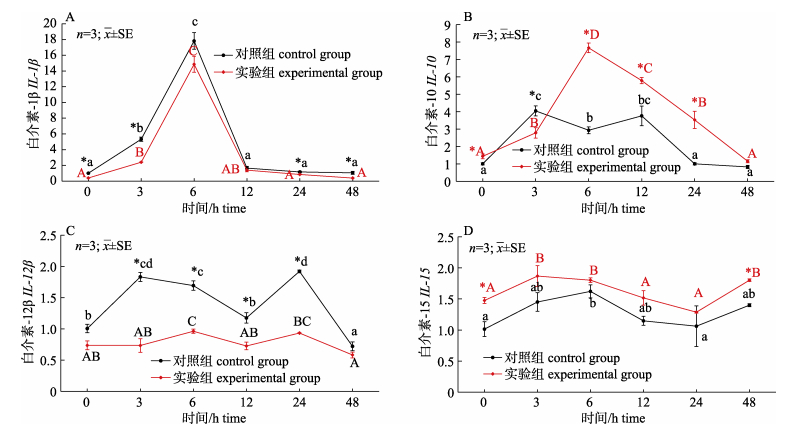
|
图 5 血根碱对脂多糖诱导后对黄鳝肠道IL-1β(A)、IL-10(B)、IL-12β(C)和IL-15(D)基因表达量的影响 不同小写字母与大写字母分别表示对照组和实验组在注射LPS后不同时间差异显著(P < 0.05).图中*表示对照组与实验组在同时间节点差异显著(P < 0.05). Fig.5 Effect of sanguinarine on the gut IL-1β(A), IL-10(B), IL-12β (C)and IL-15 (D)genes expression of Monopterus albus induced by LPS Different small letters and capital letters in the figure show significant difference at different times after LPS injection (P < 0.05) in the control and the experimental group, respectively. * indicates significant difference between the control group and the experimental group at the same time (P < 0.05). |
由图 6可知, 在0 h时, 实验组肠道中TGF-β1和TGF-β3基因相对表达量显著高于对照组(P < 0.05);腹腔注射LPS后, 对照组TGF-β1和TGF-β2基因相对表达量随时间呈先上升后下降再上升的趋势, TGF-β1和TGF-β2基因相对表达量分别在3 h和6 h时显著升高(P < 0.05);实验组与对照组变化趋势一致, 但TGF-β1和TGF-β3基因相对表达量在注射LPS后一直高于对照组, 且在3 h、12 h和24 h时TGF-β1显著高于对照组(P < 0.05)。
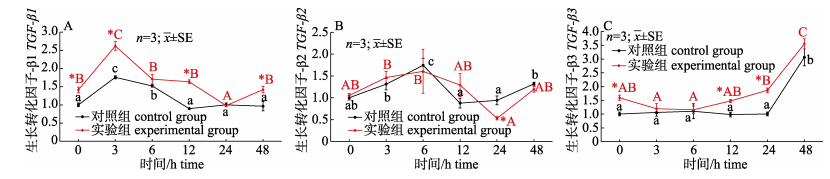
|
图 6 血根碱对脂多糖诱导后对黄鳝肠道TGF-β1(A)、TGF-β2(B)和TGF-β3(C)表达量的影响 不同小写字母与大写字母分别表示对照组和实验组在注射LPS后不同时间差异显著(P < 0.05).*表示对照组与实验组在同时间节点差异显著(P < 0.05). Fig.6 Effect of sanguinarine on the gut TGF-β1(A), TGF-β2(B) and TGF-β3(C) genes expression of Monopterus albus induced by LPS Different small letters and capital letters in the figure show significant difference at different times after LPS injection (P < 0.05) in the control and the experimental group, respectively. * indicates significant difference between the control group and the experimental group at the same time (P < 0.05). |
GLU和COR是鱼类应激的灵敏信号, 会随着应激程度的不同而发生改变[18]。研究显示, 当机体受到应激时, 需要消耗更多的能量来缓解所引起的不适, 会引起血清中COR和GLU含量上升[19]。本实验结果表明, 黄鳝腹腔注射LPS 3 h后, 血清中GLU、COR含量显著升高, 分别在6 h和12 h时恢复至正常水平, 表明注射LPS能够使黄鳝产生应激反应。这与在虹鳟中研究结果一致, 腹腔注射1.3 mg/kg LPS后3~8 h血清中COR显著增加[14]。但也有研究表明鱼类对LPS的耐受度较高, 一般不会出现显著影响[20]。这些不同的结果暗示, LPS是否会引起鱼类产生应激反应与LPS的剂量、鱼的种类、鱼的规格等因素有关, 但这一点还需大量实验证明。此外, 实验组的GLU和COR含量在3 h时低于对照组, 并且恢复至正常水平速度更快, 这说明血根碱能够缓解黄鳝由LPS诱导的免疫应激反应, 并且缩短机体对LPS应激的适应时间。
鱼类不具有健全的免疫机制, 主要依靠非特异性免疫系统来应对环境刺激和病原入侵[21]。其中补体系统是抵抗微生物感染的重要成分, 是先天性和适应性免疫的交汇点, 包括经典途径、凝集素途径和旁路途径三条激活途径, C3和C4是其重要成分[22]。AKP是机体内重要的解毒物质, 是动物溶酶体重要的组成部分, 在机体非特异性免疫反应中发挥着重要作用[23]。此外, IgM是鱼类最主要的免疫球蛋白, 是当机体收到抗原刺激后最先产生的抗体, 具有很强的细胞毒活性和细胞溶解活性[24]。蒋广震等[25]研究表明, 在斑点叉尾鮰腹腔注射LPS后, 能够诱导机体血浆补体的产生, 并在6 h达到最高峰。这与本实验结果相类似, 腹腔注射LPS后, 血清中AKP、IgM和C4含量在3~6 h达到峰值, 但在注射LPS后, 血清中C3一直呈上升的趋势, 其中可能原因是补体具有3条激活途径, 其中C4参与其中两条途径分别为经典途径和凝激素途径, 而C3参与3条途径分别为经典途径、凝激素途径和替代途径[26], 在LPS注射后0~48 h内替代途径可能一直处于激活状态, 从而使得C3含量一直升高, 但其中具体作用机制还需进一步研究发现。实验组在注射前黄鳝血清中IgM、C3和C4的含量都高于对照组, 与在断奶仔猪[27]中研究结果一致。并且在注射LPS后, 实验组的AKP、IgM和C4的含量上升幅度高于对照组, 这表明血根碱能够促使机体相关免疫指标在受到LPS应激后快速上升, 进而有效降低LPS对鱼体的毒性, 并且相关免疫指标恢复至正常水平更快, 这些说明血根碱能够提高黄鳝的免疫能力以及在LPS诱导后产生免疫应激反应中发挥抑制作用, 增强抵抗能力, 以维持机体免疫平衡。
机体内多种抗氧化酶是维持鱼类免疫系统平衡的, 当抗氧化防御机制不足时, 机体内氧化还原控制会相应减少, 从而促使氧化抵抗压力的发生[28]。其中SOD和CAT是鱼体重要的抗氧化指标, 它在氧化与抗氧化平衡转化中起关键作用, SOD能够将超氧阴离子自由基转化成氧气和过氧化氢, CAT则能够将过氧化氢分解成氧气和水, 从而减轻细胞受损[29-30]。而MDA是自由基引发脂质过氧化反应后的最终分解产物, 由羟基阴离子攻击细胞膜所产生, 具有很强的生物毒性, 并且会破坏细胞的结构和功能[31]。有研究证实, LPS能够增加细胞还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶的表达, 从而产生大量的活性氧簇(ROS), 进而破坏线粒体[32]。相比对照组, 血根碱家族可提高黄鳝肝脏中SOD和CAT的活性, 降低肝脏中MDA含量, 并在LPS应激后添加血根碱可使肝脏中SOD活性提高, 在一定程度上降低了MDA产生, 其可能的作用机制是血根碱通过抑制NADPH的酶活性进而发挥抗氧化作用[33]。这与云龙[34]发现添加适量血根碱可提高黄羽肉鸡CAT、SOD和谷胱甘肽过氧化物酶(GSH-Px)的活性, 降低MDA的含量相一致。表明血根碱可提高黄鳝肝脏中抗氧化能力, 并抑制LPS诱导的免疫应激反应, 以维持机体免疫系统平衡。
血清中能反映机体肝脏损伤情况的两个代表性指标是GOT和GPT, 当肝脏受损或通透性改变后, 血清中GOT和GPT的活性就会升高[35-36]。本实验结果表明, 对照组黄鳝在腹腔注射LPS之后, 血清中GOT和GPT急剧上升, 这可能是因为腹腔注射LPS后造成肝脏急性损伤。这与Lun等[37]研究相类似, 在LPS攻毒后文昌鱼(Branchiostoma belcheri)血清中转氨酶含量显著升高。而实验组比对照组恢复至正常水平速度更快, 这说明血根碱能够有效地抑制LPS诱导后而产生的机体急剧肝损伤。
肠道炎症是一种涉及多种类型的免疫和非免疫细胞的生物反应, 通常是由外源性物质和组织损伤产物所激发, 伴随着促炎细胞因子的产生、免疫细胞的募集和活化以及自由基的产生[38]。其中白细胞介素是由多种细胞产生并作用于多种细胞的一类细胞因子, 在传递信息、激活与调节免疫细胞, 介导T、B细胞活化、增殖与分化及在炎症反应中起重要作用[39]。众所周知, IL-1β在免疫应答中发挥重要作用, 是最重要、最快的炎症介质之一[40]。IL-12β是编码IL-12的两个亚基组成的异二聚体之一, 是促炎细胞因子和前列腺细胞因子[41]。有研究表明, 血根碱预处理的细胞可以显著降低LPS刺激的促炎因子的mRNA表达[42]。本实验结果很好地验证了这一点, 腹腔注射LPS后, 黄鳝肠道中IL-1β和IL-12β相对表达量在3~ 6 h显著上升, 但与对照组相比, 实验组可以显著降低由LPS刺激后引起的IL-1β和IL-12β mRNA表达量上升, 并且使机体快速恢复至正常水平。IL-10具有抗炎特性, 减少促炎介质的产生, 抑制抗原呈递[43]。IL-15是细胞因子中重要成员之一, 其特点是具有维持T细胞记忆的能力和具有自然灭活T细胞生长因子的功能[44]。本研究结果显示, 在0 h时, 添加血根碱组黄鳝肠道中IL-10和IL-15的基因表达量高于对照组, 并且在LPS刺激后其表达量上升并显著高于对照组, 这表明血根碱能够降低LPS刺激黄鳝后而产生的炎症反应, 并且有效抑制炎症介质的表达。同样在小鼠的实验中也有相类似的结果, 血根碱可以降低小鼠血清中LPS诱导的炎性因子TNF-α、白介素-6(IL-6)、一氧化氮(NO)的表达水平[45-46], 进而表现出良好的抗炎效果。
生长转化因子-β(TGF-β)作为一种免疫调节细胞因子, 其中包括3个亚型: TGF-β1、TGF-β2和TGF-β3, 三者功能类似, 可能下调其他细胞因子的表达和细胞因子诱导的作用, 在维持免疫平衡和重建免疫稳态中发挥重要作用[47]。有研究发现, 当大鳞大麻哈鱼(Oncorhynchus tshawytscha)[48]暴露于杀虫剂时, 体内TGF-β表达量上升, 这与本实验研究一致, 表明TGF-β的上升可能与炎症过程有关。同时本研究结果表明, 当与对照组相比, 实验组可促进LPS刺激后肠道中TGF-β1和TGF-β3的基因表达。这与在鲤[49]中的研究相类似, 血根碱处理后可升高其鳃、肾脏和脾脏中TGF-β基因表达量, 这可能是投喂血根碱可抑制体内促炎因子有关, 因为有研究发现TGF-β的上升是由炎症介质的增加而诱导的, 进而为了抑制炎症反应[50]。
4 结论在本实验条件下, 腹腔注射10 mg/kg LPS能够诱导黄鳝产生免疫应激反应, 在3~6 h时出现高峰, 并在6 h之后相继恢复至正常水平; 饲料中添加750 μg/kg血根碱能够有效改善黄鳝由LPS诱导的血清免疫、肝脏抗氧化指标及肠道炎症相关基因的变化, 进而有效抑制LPS诱导而产生免疫应激及肠道炎症反应。
| [1] |
Fisheries and Fisheries Administration Ministry of Agriculture. China Fisheries Statistical Yearbook[M]. Beijing: China Agriculture Press, 2018: 24-25. [农业部渔业渔政管理局. 中国渔业年鉴[M]. 北京: 中国农业出版社, 2018: 24-25.]
|
| [2] |
Tang T, Zhong L, Xun Z L, et al. Effects of fish meal replacement by three kinds of soybean products on growth performance, intestinal digestive enzyme activities and serum biochemical indices of rice filed eels (Monopterus albus)[J]. Chinese Journal of Animal Nutrition, 2019, 31(2): 970-980. [唐涛, 钟蕾, 郇志利, 等. 3种大豆产品替代鱼粉对黄鳝生长性能、肠道消化酶活性和血清生化指标的影响[J]. 动物营养学报, 2019, 31(2): 970-980.] |
| [3] |
Wang Y P, Ma Y. Potential public hazard of using antibiotics in livestock industry[J]. Chinese Journal of Antibiotics, 2008, 33(9): 519-523. [王云鹏, 马越. 养殖业抗生素的使用及其潜在危害[J]. 中国抗生素杂志, 2008, 33(9): 519-523.] |
| [4] |
Casewell M, Friis C, Marco E, et al. The European ban on growth-promoting antibiotics and emerging consequences for human and animal health[J]. Journal of Antimicrobial Chemotherapy, 2003, 52(2): 159-161. |
| [5] |
Liu B, Ge X P, Xie J, et al. Effects of anthraquinone extract from Rheum officinale Bail on the physiological responses and HSP70 gene expression of Megalobrama amblycephala under Aeromonas hydrophila infection[J]. Fish & Shellfish Immunology, 2012, 32(1): 1-7. |
| [6] |
Basha K A, Raman R P, Prasad K P, et al. Effect of dietary supplemented andrographolide on growth, non-specific immune parameters and resistance against Aeromonas hydrophila in Labeo rohita (Hamilton)[J]. Fish & Shellfish Immunology, 2013, 35(5): 1433-1441. |
| [7] |
Hou B, Zeng J G. Biolological activities of Sanguinarine and application of Macleaya cordata extract in animal production[J]. Chinese Journal of Animal Nutrition, 2018, 30(2): 413-420. [侯博, 曾建国. 血根碱的生物学活性及博落回提取物在动物生产中的应用[J]. 动物营养学报, 2018, 30(2): 413-420.] |
| [8] |
Singh C K, Kaur S, George J, et al. Molecular signatures of sanguinarine in human pancreatic cancer cells: A large scale label-free comparative proteomics approach[J]. Oncotarget, 2015, 6: 10335-10349. |
| [9] |
Liu Y, Jiao R, Ma Z G, et al. Sanguinarine inhibits angiotensin Ⅱ-induced apoptosis in H9c2 cardiac cells via restoring reactive oxygen species-mediated decreases in the mitochondrial membrane potential[J]. Molecular Medicine Reports, 2015, 12(3): 3400-3408. |
| [10] |
He X Y. Effects of Sanguinarine on the growth performance, nutrient digestibility and blood biochemical indexes of weaned piglets[D]. Changsha: Hunan Agricultural University, 2010. [何夏阳.血根碱对断奶仔猪生长性能、养分消化率和血液生化指标的影响[D].长沙: 湖南农业大学, 2010.] http://cdmd.cnki.com.cn/article/cdmd-10537-1011067414.htm
|
| [11] |
Lee K W, Kim J S, Oh S T, et al. Effects of dietary sanguinarine on growth performance, relative organ weight, cecal microflora, serum cholesterol level and meat quality in broiler chickens[J]. The Journal of Poultry Science, 2015, 52(1): 15-22. |
| [12] |
Molteni M, Gemma S, Rossetti C. The role of toll-like receptor 4 in infectious and noninfectious inflammation[J]. Mediators of Inflammation, 2016, 2016: 1-9. |
| [13] |
Liu Z J, Zhao J, Bo Y X, et al. Expression patterns of IL-8 protein during bacterial LPS-induced inflammatory response in grass carp (Ctenopharyngodon idella)[J]. Journal of Fisheries of China, 2017, 41(7): 1028-1035. [柳昭君, 赵杰, 卜云璇, 等. IL-8在LPS诱导的草鱼炎症过程中的表达特征[J]. 水产学报, 2017, 41(7): 1028-1035.] |
| [14] |
Holland J W, Pottinger T G, Secombes C J. Recombinant interleukin-1 beta activates the hypothalamic-pituitary- interrenal axis in rainbow trout, Oncorhynchus mykiss[J]. Journal of Endocrinology, 2002, 175(1): 261-267. |
| [15] |
Zou J, Secombes C J, Long S, et al. Molecular identification and expression analysis of tumor necrosis factor in channel catfish (Ictalurus punctatus)[J]. Developmental & Comparative Immunology, 2003, 27(10): 845-858. |
| [16] |
AO AC. Official Methods of Analysis of AOAC International[M]. 16th ed. Gaithersburg MD: Association of Official Analytical Chemists International, 1995: 1094.
|
| [17] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. |
| [18] |
Tolussi C E, Hilsdorf A W S, Caneppele D, et al. The effects of stocking density in physiological parameters and growth of the endangered teleost species piabanha, Brycon insignis (Steindachner, 1877)[J]. Aquaculture, 2010, 310(1-2): 221-228. |
| [19] |
Tian Q Q, Hu Y, Mao P, et al. Effect of dietary taurine supplementation on growth, intestine structure and resistance to acute crowding stress in juvenile black carp (Mylopharyngodon piceus) fed low fish meal diets[J]. Journal of Fisheries of China, 2016, 40(9): 1330-1339. [田芊芊, 胡毅, 毛盼, 等. 低鱼粉饲料中添加牛磺酸对青鱼幼鱼生长、肠道修复及抗急性拥挤胁迫的影响[J]. 水产学报, 2016, 40(9): 1330-1339.] |
| [20] |
Iliev D B, Roach J C, Mackenzie S, et al. Endotoxin recognition: In fish or not in fish?[J]. FEBS Letters, 2005, 579(29): 6519-6528. |
| [21] |
Hu Y, Tan B P, Mai K S, et al. Effects of dietary probiotic on growth, immunity and intestinal bacteria of juvenile Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2008, 15(2): 244-251. [胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J]. 中国水产科学, 2008, 15(2): 244-251.] |
| [22] |
Yu Y C, Zhang C, Xia X L, et al. Evolution of the complement system[J]. Chinese Bulletin of Life Sciences, 2012, 24(4): 362-367. [余英才, 张纯, 夏循礼, 等. 补体系统的进化[J]. 生命科学, 2012, 24(4): 362-367.] |
| [23] |
Zhang W N, Lin X, Wang S K, et al. Effects of astragalus polysaccharide on nonspecific immunity and endocrine function in stomach and foregut of tilapia (Oreochromis spp.)[J]. Chinese Journal of Animal Nutrition, 2010, 22(2): 401-409. [张伟妮, 林旋, 王寿昆, 等. 黄芪多糖对罗非鱼非特异性免疫和胃肠内分泌功能的影响[J]. 动物营养学报, 2010, 22(2): 401-409.] |
| [24] |
Yin S T, Liu B L, Huang B, et al. Effects of crowding stress on immunity and stress index of turbot (Psetta maxima) injected with vaccine[J]. Fishery Modernization, 2017, 44(1): 26-34. [殷述亭, 刘宝良, 黄滨, 等. 拥挤胁迫对已接种疫苗的大菱鲆部分免疫和应激指标的影响[J]. 渔业现代化, 2017, 44(1): 26-34.] |
| [25] |
Jiang G Z, Zhou M, Li X F, et al. Effect of glycyrrhetinic acid (GA) on the physiological responses and immunoreactions of channel catfish (Ictalurus punctatus) injection lipopolysaccharide (LPS)[J]. Journal of Fisheries of China, 2016, 40(9): 1368-1375. [蒋广震, 周嫚, 李向飞, 等. 甘草次酸对斑点叉尾鮰免疫应激下血浆抗氧化酶和免疫指标的影响[J]. 水产学报, 2016, 40(9): 1368-1375.] |
| [26] |
Wang Z P, Zhang S C, Wang G F. Advances on the complement components, characteristic and function of complement system in fish[J]. Acta Hydrobiologica Sinica, 2008, 32(5): 760-769. [王志平, 张士璀, 王光锋. 鱼类补体系统成分及补体特异性和功能的研究进展[J]. 水生生物学报, 2008, 32(5): 760-769.] |
| [27] |
Chen J S, Kang B J, Zeng J G, et al. Effects of dietary sanguinarine on growth performance, intestinal mucosal morphology and immune function of small intestinal mucosa of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2018, 30(5): 1845-1853. [陈家顺, 康宝聚, 曾建国, 等. 血根碱对断奶仔猪生长性能、肠道形态结构及小肠黏膜免疫功能的影响[J]. 动物营养学报, 2018, 30(5): 1845-1853.] |
| [28] |
Helland S J, Grisdale-Helland B. Replacement of fish meal with wheat gluten in diets for Atlantic halibut (Hippoglossus hippoglossus): Effect on whole-body amino acid concentrations[J]. Aquaculture, 2006, 261(4): 1363-1370. |
| [29] |
Mourente G, Bell J G, Tocher D R. Does dietary tocopherol level affect fatty acid metabolism in fish?[J]. Fish Physiology and Biochemistry, 2007, 33(3): 269-280. |
| [30] |
Jovanović-Galović A, Blagojević D P, Grubor-Lajsić G, et al. Role of antioxidant defense during different stages of preadult life cycle in European corn borer (Ostrinia nubilalis, Hubn.): Diapause and metamorphosis[J]. Archives of Insect Biochemistry and Physiology, 2004, 55(2): 79-89. |
| [31] |
Zhang Y Y, Song L P, Hu B, et al. Effect of curcumin on growth performance and protective effect of liver injury induced by carbon tetrachloride in Oreochromis niloticus[J]. Journal of Fishery Sciences of China, 2018, 25(6): 1271-1280. [张媛媛, 宋理平, 胡斌, 等. 饲料中添加姜黄素对尼罗罗非鱼幼鱼生长和四氯化碳诱导肝损伤的影响[J]. 中国水产科学, 2018, 25(6): 1271-1280.] |
| [32] |
Zhang Z H, Yu Y, Wei S G, et al. Centrally administered lipopolysaccharide elicits sympathetic excitation via NAD (P)H oxidase-dependent mitogen-activated protein kinase signaling[J]. Journal of Hypertension, 2010, 28(4): 806-816. |
| [33] |
Vrba J, Hrbáč J, Ulrichová J, et al. Sanguinarine is a potent inhibitor of oxidative burst in DMSO-differentiated HL-60 cells by a non-redox mechanism[J]. Chemico-Biological Interactions, 2004, 147(1): 35-47. |
| [34] |
Yun L. Effects of Sanguinarine preparation on the growth performance and antioxidation function of yellow broilers[D]. Changsha: Hunan Agricultural University, 2016. [云龙.血根碱制剂对黄羽肉鸡生长性能及抗氧化功能的影响[D].长沙: 湖南农业大学, 2016.] http://cdmd.cnki.com.cn/Article/CDMD-10537-1017033453.htm
|
| [35] |
Song Z D, Li H Y, Wang J Y, et al. Effects of fishmeal replacement with soy protein hydrolysates on growth performance, blood biochemistry, gastrointestinal digestion and muscle composition of juvenile starry flounder (Platichthys stellatus)[J]. Aquaculture, 2014, 426-427: 96-104. |
| [36] |
Wang L N, Liu W B, Lu K L, et al. Effects of dietary carbohydrate/lipid ratios on non-specific immune responses, oxidative status and liver histology of juvenile yellow catfish Pelteobagrus fulvidraco[J]. Aquaculture, 2014, 426-427: 41-48. |
| [37] |
Lun L M, Zhang S C, Liang Y J. Alanine aminotransferase in amphioxus: presence, localization and up-regulation after acute lipopolysaccharide exposure[J]. BMB Reports, 2006, 39(5): 511-515. |
| [38] |
Karin M, Clevers H. Reparative inflammation takes charge of tissue regeneration[J]. Nature, 2016, 529(7586): 307-315. |
| [39] |
Gao S, Yu T, Zhou J X, et al. A review of interleukin and receptors in fish[J]. Chinese Journal of Fisheries, 2014, 27(3): 62-64. [高珊, 余涛, 周景祥, 等. 鱼类白介素及其受体的研究[J]. 水产学杂志, 2014, 27(3): 62-64.] |
| [40] |
Lu C, Ling F, Ji J, et al. Expression of immune-related genes in goldfish gills induced by Dactylogyrus intermedius infections[J]. Fish & Shellfish Immunology, 2013, 34(1): 372-377. |
| [41] |
Wu B, Huang C H, Kato-Maeda M, et al. Messenger RNA expression of IL-8, FOXP3, and IL-12β differentiates latent tuberculosis infection from disease[J]. The Journal of Immunology, 2007, 178(6): 3688-3694. |
| [42] |
Pěnčíková K, Kollár P, Müller Z V, et al. Investigation of sanguinarine and chelerythrine effects on LPS-induced inflammatory gene expression in THP-1 cell line[J]. Phytomedicine, 2012, 19(10): 890-895. |
| [43] |
Moore K W, de Waal Malefyt R, Coffman R L, et al. Interleukin-10 and the interleukin-10 receptor[J]. Annual Review of Immunology, 2001, 19(1): 683-765. |
| [44] |
Kanti Ghosh A, Sinha D, Mukherjee S, et al. IL-15 temporally reorients IL-10 biased B-1a cells toward IL-12 expression[J]. Cellular & Molecular Immunology, 2016, 13(2): 229-239. |
| [45] |
Niu X F, Fan T, Li W F, et al. The anti-inflammatory effects of sanguinarine and its modulation of inflammatory mediators from peritoneal macrophages[J]. European Journal of Pharmacology, 2012, 689(1-3): 262-269. |
| [46] |
Li W F, Li H N, Yao H, et al. Pharmacokinetic and anti-inflammatory effects of sanguinarine solid lipid nanoparticles[J]. Inflammation, 2014, 37(2): 632-638. |
| [47] |
Prud'Homme G J, Piccirillo C A. The inhibitory effects of transforming growth factor-beta-1 (TGF-β1) in autoimmune diseases[J]. Journal of Autoimmunity, 2000, 14(1): 23-42. |
| [48] |
Eder K J, Leutenegger C M, Wilson B W, et al. Molecular and cellular biomarker responses to pesticide exposure in juvenile chinook salmon (Oncorhynchus tshawytscha)[J]. Marine Environmental Research, 2004, 58(2-5): 809-813. |
| [49] |
Zhang C, Ling F, Chi C, et al. Effects of praziquantel and sanguinarine on expression of immune genes and susceptibility to Aeromonas hydrophila in goldfish (Carassius auratus) infected with Dactylogyrus intermedius[J]. Fish & Shellfish Immunology, 2013, 35(4): 1301-1308. |
| [50] |
Faliex E, Dasilva C, Simon G, et al. Dynamic expression of immune response genes in the sea bass, Dicentrarchus labrax, experimentally infected with the monogenean Diplectanum aequans[J]. Fish & Shellfish Immunology, 2008, 24(6): 759-767. |
 2020, Vol. 27
2020, Vol. 27

