2. 浙江省海洋水产研究所, 浙江省海洋渔业资源可持续利用技术研究重点实验室, 农业农村部重点渔场渔业资源科学观测实验站, 浙江 舟山 316021
2. Key Laboratory of Sustainable Utilization of Technology Research for Fisheries Resources of Zhejiang Province, Marine Fishery Research Institute of Zhejiang Province; Scientific Observing and Experimental Station of Fishery Resources for Key Fishing Grounds, Ministry of Agriculture and Rural Affairs, Zhoushan 316021, China
龙头鱼[Harpadon nehereus (Hamilton, 1822)]隶属于辐鳍鱼纲(Actinopterygii), 仙鱼目(AulopIformes), 龙头鱼科(Harpadontidae), 龙头鱼属, 是广泛分布于印度-西太平洋近岸及河口区的常见中下层鱼类, 常以小型鱼类、甲壳类和头足类为食[1]。随着传统渔业资源的衰退和捕捞作业结构的调整, 以龙头鱼为代表的中小型鱼类在渔获物中所占比例呈上升趋势, 近年来调查显示龙头鱼资源量丰富, 具有较好的开发潜力[2-4], 但部分海区仍存在小型化、低龄化和结构简单化的趋势[5]。渔业管理通常需要了解和掌握渔业对象的生物学特征和种群结构变化规律, 并在此基础上分配不同海区的捕捞强度, 从而为渔业资源评估和开发管理提供重要参考依据[6-7]。传统的形态学方法虽然能够反映不同形态特征之间的共变现象, 但难以体现形态变化的空间格局, 也不能体现既保存变量间的几何关系[8-9]。20世纪80年代初, “框架法”(truss network)作为一种形态描述的新方法被提出, 即在生物体上选取具有代表性和标志性的坐标点(landmark)和半坐标点(semi-landmark), 使其在各方向连接成线, 采用几何方法精细描述生物体形态特征[10-12]。目前, 该方法已广泛应用于鱼类种间系统发育及种群鉴别研究[13-16]。
龙头鱼是广泛分布于中国黄海、东海和南海的中小型经济鱼类之一, 也是近岸海洋生态系统食物链的重要环节。近年来, 随着龙头鱼自然资源所承受压力逐渐增大, 如何实现其资源的健康和可持续利用、使种群数量变化维持一定规模, 就变得十分重要。本研究结合传统形态学测定和几何框架度量法, 采用单因素方差分析(one-way analysis of variance, one-way ANOVA)、主成分分析(principal component analysis, PCA)、聚类分析(clustering analysis, CA)等多元统计方法, 对中国沿海不同群体的龙头鱼形态差异进行比较分析, 通过筛选贡献率高的形态特征值建立判别函数, 以期为龙头鱼种群鉴别提供参考资料, 也为合理制定其种质资源保护对策和管理措施提供科学依据。
1 材料与方法 1.1 样品采集与保存本实验测定的龙头鱼样本于2018年8月至2019年11月采自中国8个不同海域。新鲜样本冷冻运回实验室, 室温下解冻后随机选取一定数量的个体进行测定。具体采样时间、数量及体长信息见表 1。
|
|
表 1 龙头鱼样本信息 Tab.1 Sample information of Harpadon nehereus |
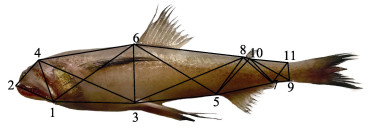
使用传统形态学和框架结构数据结合的方式对龙头鱼进行形态学测量[17]。其中, 传统形态学数据包括:全长(TL)、体长(BL)、头长(HL)、眼径(ED)、眼间隔(EI)、口裂长(MCL)、尾柄高(CPD)、脂鳍基长(DL)和臀鳍基长(SA)共计9个指标(图 1)。框架数据包括D2-D4 (表示标点2至标点4之间的距离, 下同)、D4-D6、D6-D8、D10-D11、D9-D7、D5-D3、D3-D1、D1-D2、D1-D4、D1-D6、D3-D4、D3-D6、D3-D8、D5-D6、D5-D8、D5-D10、D7-D8、D7-D10、D7-D11和D9-D10 (图 2)。用直尺测量体长和全长, 精确到0.1 cm, 用电子数显卡尺测量其余数据, 精确到0.1 mm。

|
图 1 龙头鱼传统形态学测量指标 BL:体长; CPD:尾柄高; DL:脂鳍基长; ED:眼径; HL:头长; MCL:口裂长; SA:臀鳍基长; TL:全长. Fig.1 Traditional measurements on Harpadon nehereus BL: body length; CPD: caudal peduncle distance; DL: length of adipose fin base; ED: eye diameter; HL: head length; MCL: mouth crack length; SA: length of anal fin base; TL: total length. |
|
图 2 龙头鱼框架结构示意图
1‒11表示11个坐标点: 1.前鳃盖骨腹侧起点; 2.吻端; 3.腹鳍起点; 4.枕骨后末端; 5.臀鳍起点; 6.背鳍起点; 7.臀鳍基部末端; 8.脂鳍起点; 9.尾鳍基部末端; 10.脂鳍基部末端; 11.尾鳍基部上端. Fig.2 Truss network of Harpadon nehereus 1‒11 denote eleven landmark points: 1. Origin of the preopercle on the ventral; 2. Tip of snout; 3. Origin of pelvic fin; 4. Distal tip of occiput; 5. Origin of anal fin; 6. Origin of dorsal fin; 7. Terminus of anal fin base; 8. Origin of adipose fin; 9. Terminus of caudal fin base; 10. Terminus of adipose fin base; 11. Dorsal origin of caudal fin base. |
运用Microsoft Excel将测量数据进行初步处理。为消除鱼体规格对参数值的影响, 将眼径、眼间隔和口裂长除以对应的头长, 其余实测特征值均除以体长, 并将得到的27项比值性状(体长和头长用于数据的标准化校正, 未作分析数据用)[18-19]运用SPSS 24.0[20]统计分析软件进行数据处理。
采用主成分分析法对199尾龙头鱼样品标准化的形态特征值进行比较, 选取载荷系数、贡献率和特征值排序前7位的主成分进行分析, 并根据第一、二主成分的得分绘制散点图; 使用单因素方差分析以检验不同地理种群比值性状的差异显著性, 以0.05为显著性水平, 多重比较后具有方差齐性的变量采用最小显著差法(least significance difference method, LSD), 未假定方差齐性的变量采用Tamhane’s T2法; 采用欧氏距离的最短系统聚类法, 绘制表示群体间差异距离的谱系图; 采用逐步判别法对8个龙头鱼群体进行判别分析, 对形态差异作用较大的9个参数建立判别公式, 并计算判别准确率和综合判别准确率。计算公式如下:
判别准确率P(%) = (判别正确的个体数/实际个体数)×100
| $ {综合判别率=\sum\nolimits_{i=1}^{n}{{{A}_{i}}}}/{\sum\nolimits_{i=1}^{n}{{{B}_{i}}}}\; $ |
式中, 实际个数是指该群体所测量的个体数目, 判别正确的个数是指被判为该群体的个体数, Ai为第i个体中判别正确的个体数,Bi为第i个群体的实际个体数,n为群体数目。
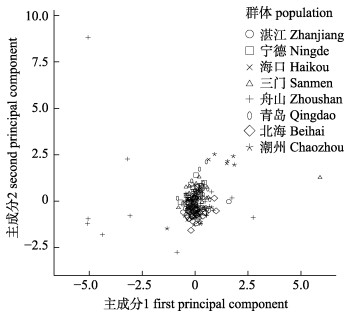
2 结果与分析 2.1 主成分分析对标准化后的量度特征变量进行主成分分析(表 2), 结果表明, 前7个主成分贡献率累计为71.481%, 其分别为34.528%、8.362%、8.056%、7.129%、5.140%、4.409%和3.856%。各主成分所对应的少数特征变量直观地解释不同群体的形态差异和变异来源。第1主成分中作用最大的形态学指标为D5-D6、D7-D5和D3-D8, 其负荷值分别为0.868、0.794、0.790, 主要反映了臀鳍大小及腹鳍至臀鳍间的躯体斜向大小差异。第2主成分中占主要贡献的指标是EI和MCL, 分别反映双眼间距和口裂大小。根据第1主成分和第2主成分绘制散点图可见(图 3), 在横轴(PC1)上舟山群体与其他群体差异较大, 纵轴(PC2)上潮州群体与其他群体存在一定差异。
|
|
表 2 龙头鱼主成分分析的因子负荷值 Tab.2 Factor loadings of principal components extracted in Harpadon nehereus |
|
图 3 龙头鱼第一、二主成分分布图 Fig.3 Plot of the first and second principal components from PCA of Harpadon nehereus |
单因素方差分析结果显示, 仅特征值MCL/ HL、D3-D8/BL、D5-D6/BL和D7-D10/BL在各群体间未检测到显著性差异, 表明这几个特征值影响的独立组群不来自正态分布的总体, 故采用Tamhane’s T2法, 其余特征值采用LSD法(表 3)。
|
|
表 3 8个龙头鱼群体可量性状的单因素方差分析结果 Tab.3 The results of one-way ANOVA for morphometric characters of eight Harpadon nehereus populations |
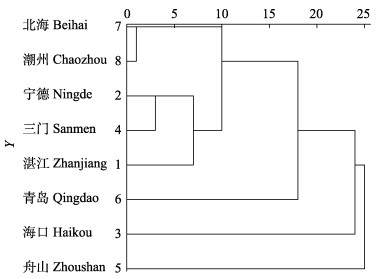
本研究对标准化的变量信息进行聚类分析, 以系统聚类树横坐标值15为界, 可将8个群体分为4个组, 舟山、海口和青岛群体各为一组, 其余群体为一组(图 4)。结果表明舟山群体与其余群体遗传分化较大, 亲缘关系较远, 其次是海口群体与青岛群体。
|
图 4 基于度量特征构建的龙头鱼群体聚类图 Fig.4 Dendrogram of Harpadon nehereus populations constructed by metrical characteristics |
基于27个标准化处理后的形态特征值对8个龙头鱼群体进行判别分析, 样本被判入青岛和北海群体的判别准确率为100%, 被判入海口群体的判别准确率达95.8%, 综合辨别率为88.3%。在确保判别准确的前提下, 采用逐步回归分析法选取9个作用最大的特征值进行再次判别分析, 判别准确率为30.0%~100%, 青岛群体判别准确率依然为100%, 舟山群体判别准确率降至30% (表 4)。
|
|
表 4 8个龙头鱼群体的判别分析结果 Tab.4 Discriminant analysis results of eight Harpadon nehereus populations |
各群体判别公式如下。
湛江: Y=21X1+91X2+23X3+5X4+17X5–13X6+ 23X7+13X8–11X9–109
宁德: Y=5X1+91X2+19X3+13X4+17X5–10X6+ 19X7+18X8–9X9–106
海口: Y=56X1+81X2+19X3+3X4+20X5–11X6+ 25X7–10X8–4X9–108
三门: Y=10X1+88X2+18X3+20X4+15X5–13X6+ 22X7+7X8–3X9–109
舟山: Y=23X1+82X2+15X3+7X4+16X5–8X6+ 25X7+9X8–4X9–94
青岛: Y=22X1+87X2+14X3+82X4+12X5–48X6+ 4X7+35X8–20X9–138
北海: Y=82X1+79X2+18X3+3X4+22X5–23X6+ 34X7–16X8–4X9–111
潮州: Y=168X1+67X2+17X3–2X4+22X5–24X6+ 39X7–6X8–3X9–115
式中, X1=ED/HL, X2=MCL/HL, X3=D5-D3/BL, X4=D9-D10/BL, X5=D1-D6/BL, X6=D7-D11/BL, X7= D5-D10/BL, X8=D8-D10/BL, X9=D9-D7/BL。
3 讨论生物个体间在形态结构上表现出的差异主要由基因决定, 也可能是由生存环境或群体所处的生活史不同所造成[21-22]。大量资料表明, 结合传统可数可量性状和框架数据等形态信息的多元分析手段, 可有效开展鱼类种质鉴定和群体判别研究[23-27]。本研究基于多变量形态学度量方法, 采用多元数理统计分析方法对27项形态学特征性状进行分析, 探讨8个龙头鱼群体间的形态差异。
有研究表明, 鱼类的形态特征在脊椎动物中较易受外界环境的影响[28]。主成分分析结果显示, 舟山和潮州群体形态特征与其他群体有明显差异, 存在一定程度分化。舟山渔场作为钱塘江、长江和甬江的入海口, 受到日本寒流、黄海冷水团和日本暖流的共同作用, 使得该水域温、盐度变化较大[29], 而潮州东临台湾海峡这一重要海上交通要道, 海上航运与交通运输频繁。推测这两处海域特殊的自然环境条件和人类活动造成了龙头鱼形态上的变化。主成分1和主成分2对龙头鱼形态特征变化的贡献率较大。主成分1主要反映了臀鳍基长和鱼体腹鳍起点至臀鳍末端之间躯体斜向大小的差异, 其中, D5-D6/BL、D5-D7/BL、D3-D8/ BL这3个比例性状的负荷值排名前3位, 表明躯体长度和臀鳍位置是区分不同群体龙头鱼的主要特征性状, 这与梁述章等[30]认为躯干部最能用于区分不同群体棘头梅童鱼(Collichthys lucidus)的研究结果一致。此外, 杜晓雪等[31]通过比较不同海域/时期龙头鱼生长参数, 发现龙头鱼躯体长度与捕捞强度存在一定相关性。因此, 本研究认为, 在使用传统形态学数据对不同地理群体龙头鱼进行鉴别研究时, 需要将躯体长度和臀鳍位置纳入考量范畴, 并在此基础上根据体长差异有针对性地制定开捕规格以保护其资源量, 防止过度开发。主成分2中起主要作用的是眼间隔/头长(EI/ HL)和口裂长/头长(MCL/HL), 表明双眼间的距离和口裂大小也是区分不同地理群体龙头鱼的重要性状参数。黄颡鱼(Pelteobagrus fulvidraco)[32]、唐鱼(Tanichthys albonubes)[33]和高原裸裂尻鱼(Schizopygopsis stoliczkai)[34]形态学研究显示, 鱼体头部变异与饵料因素有关。据此推测龙头鱼头部形态特征的差异可能与不同生境中饵料食物的组成和摄食行为有关, 例如舟山海域丰富的有机质促进了浮游生物的大量繁殖, 为这里的鱼类提供了充足的饵料, 从而促进了龙头鱼头部特征的改变。
聚类分析显示舟山群体位于系统树的最外层, 表明该群体与其他群体差异较大。基于线粒体Cyt b基因序列构建的单倍型星状图也同样显示出舟山群体单倍型变异最大[35]。海口和青岛分别作为采样点的南北两端, 其样本随后依次聚类在舟山群体的内侧, 剩余群体聚到一类。这一聚类结果与栖息在近岸和河口区的斑尾复虾虎鱼(Synechogobius ommaturus)[36]、梭鱼(Liza haematocheilus)[37]、刀鲚(Coilia ectenes)和凤鲚(C. mystus)[38]相似,这些鱼类形态变异也均未显示出与地理分布相对应的格局。造成这一现象的原因, 与龙头鱼对水温和盐度的适应性广, 加之中国沿海复杂的洋流运动有关, 不同群体间存在频繁交流导致龙头鱼形态和遗传差异受地理距离的影响较小。此外, 在歧化选择(disruptive selection)的作用下, 鱼类为寻求更多生存繁衍的机会, 会对其栖息地生态环境产生适应性形态变异, 使得群体间形态特征逐渐产生分化[25], 因此推测环境因子对龙头鱼形态特征的影响大于地理距离的影响。
对27个比例性状进行判别分析, 样本被判入青岛和北海群体的判别准确率为100%, 综合辨别率可达88.3%, 而舟山群体较低的判别率(30.0%)可能与其形态变异较大有关。基于9个主要性状建立的判别公式综合判别率为66.9%, 表明对大量保存良好且采样时间不同的龙头鱼样本, 利用该公式判别群体特征差异具有较强的可靠性, 结合传统形态学和框架法能够较好地比较其不同地理种群间的差异。在显著性水平P值小于0.05的基础上, 对所有性状进行单因素方差分析, 结果表明8个群体间形态特征值存在较大差异, 这种广泛的形态变异也从一定程度上表明该鱼类对环境具有较强的适应能力。当然,龙头鱼身体柔软且样品冻融过程导致测量存在误差, 以及因采样时间不同, 不同生活史阶段对形态测定结果也会造成影响。由于生物的形态变异与其环境适应能力和自然选择压力等因素关系密切, 近几十年来, 随着分子生物技术的飞速发展, 众多学者提出物种尤其是亚种间的形态差异要与分子差异一致[39-40]。因此, 尽管形态学方法能够对部分龙头鱼群体进行有效区分, 但要准确界定这种差异是否达到亚种水平, 抑或仍属于种群间差异, 需要将几何形态测量法与分子生物学手段乃至基因组数据相结合以期得到更科学准确的判别结果。
| [1] |
Chen D G, Zhang M Z. Marine Fishes of China[M]. Qingdao: China Ocean University Press, 2015: 417-418. [陈大刚, 张美昭. 中国海洋鱼类[M]. 青岛: 中国海洋大学出版社, 2015: 417-418.]
|
| [2] |
Ling L S. Spatial distribution and environmental characteristics of Harpodon nehereus in the East China Sea region[J]. Journal of Shanghai Ocean University, 2009, 18(1): 66-71. [林龙山. 东海区龙头鱼数量分布及其环境特征[J]. 上海海洋大学学报, 2009, 18(1): 66-71.] |
| [3] |
Luo H Z, Zhang H D, Li P F, et al. Analysis of the current situation of fishery biology of Harpodon nehereus in the East China Sea[J]. Journal of Zhejiang Ocean University (Natural Science), 2012, 31(3): 202-205, 233. [罗海舟, 张华东, 李鹏飞, 等. 东海区龙头鱼数量分布与渔业生物学现状分析[J]. 浙江海洋学院学报(自然科学版), 2012, 31(3): 202-205, 233.] |
| [4] |
Wang J Q, Huang L M, Li J, et al. Fish stock assessment of Harpodon nehereus in coastal waters of Fujian Province based on LCA models[C]//Proceedings of the Symposium on the Ichthyology Branch of China Marine Limnology Society and the Ichthyology Branch of Chinese Zoological Society, Lanzhou, 2012: 54. [王家樵, 黄良敏, 李军, 等.基于LCA模型的福建沿岸海域龙头鱼渔业资源评估[C]//中国海洋湖沼学会鱼类学分会、中国动物学会鱼类学分会2012年学术研讨会论文集, 兰州, 2012: 54.] http://d.wanfangdata.com.cn/conference/7934878
|
| [5] |
Guo J H. Research on growth characteristic and resource dynamic of four dominant fishes in the Min River Estuary, East China Sea[D]. Xiamen: Jimei University, 2019: 18-22. [郭峻宏.闽江口四种优势鱼类的生长特性及资源动态研究[D].厦门: 集美大学, 2019: 18-22.]
|
| [6] |
Begg G A, Friedland K D, Pearce J B. Stock identification and its role in stock assessment and fisheries management:An overview[J]. Fisheries Research, 1999, 43(1-3): 1-8. DOI:10.1016/S0165-7836(99)00062-4 |
| [7] |
McHich R, Charouki N, Auger P, et al. Optimal spatial distribution of the fishing effort in a multi fishing zone model[J]. Ecological Modelling, 2006, 197(3-4): 274-280. DOI:10.1016/j.ecolmodel.2006.03.026 |
| [8] |
Bai M, Yang X K. Application of geometric morphometrics in biological researches[J]. Chinese Bulletin of Entomology, 2007, 44(1): 143-147. [白明, 杨星科. 几何形态测量法在生物形态学研究中的应用[J]. 昆虫知识, 2007, 44(1): 143-147.] |
| [9] |
Ge D Y, Xia L, Lv X F, et al. Methods in geometric morphometrics and their applications in ontogenetic and evolutionary biology of animals[J]. Acta Zootaxonomica Sinica, 2012, 37(2): 296-304. [葛德燕, 夏霖, 吕雪霏, 等. 几何形态学方法及其在动物发育与系统进化研究中的应用[J]. 动物分类学报, 2012, 37(2): 296-304.] |
| [10] |
Humphries J M, Bookstein F L, Chernoff B, et al. Multivariate discrimination by shape in relation to size[J]. Systematic Biology, 1981, 30(3): 291-308. DOI:10.1093/sysbio/30.3.291 |
| [11] |
Strauss R E, Bookstein F L. The truss:Body form reconstructions in morphometrics[J]. Systematic Biology, 1982, 31(2): 113-135. DOI:10.1093/sysbio/31.2.113 |
| [12] |
Bookstein F L. Size and shape spaces for landmark data in two dimensions[J]. Statistical Science, 1986, 1(2): 181-222. DOI:10.1214/ss/1177013696 |
| [13] |
Yang T Y, Meng W, Guo Y, et al. The multivariate morphometric analysis of Schizothorax biddulphi and Schizothorax irregularis[J]. Journal of Zhejiang Ocean University (Natural Science), 2018, 37(3): 221-227. [杨天燕, 孟玮, 郭焱, 等. 塔里木裂腹鱼和厚唇裂腹鱼多变量形态学分析[J]. 浙江海洋大学学报(自然科学版), 2018, 37(3): 221-227.] |
| [14] |
Li S F, Li C H, Li J L. Analysis of morphological variations among strains of nile tilapia (Oreochromis niloticus)[J]. Acta Zoologica Sinica, 1998, 44(4): 450-457. [李思发, 李晨虹, 李家乐. 尼罗罗非鱼品系间形态差异分析[J]. 动物学报, 1998, 44(4): 450-457.] |
| [15] |
Mamuris Z, Apostolidis P, Panagiotaki P, et al. Morphological variation between red mullet populations in Greece[J]. Journal of Fish Biology, 1998, 52(1): 107-117. DOI:10.1111/j.1095-8649.1998.tb01556.x |
| [16] |
Pakkasmaa S, Piironen J. Morphological differentiation among local trout (Salmo trutta) populations[J]. Biological Journal of the Linnean Society, 2001, 72(2): 231-239. DOI:10.1111/j.1095-8312.2001.tb01313.x |
| [17] |
Shui B N, Zhao S L, Han Z Q. Ichthyology[M]. Shanghai: Tongji University Press, 2015: 1-5. [水柏年, 赵盛龙, 韩志强. 鱼类学[M]. 上海: 同济大学出版社, 2015: 1-5.]
|
| [18] |
Li S F, Cai W Q, Zhou B Y. Morphological and biochemical genetic variations among populations of blunt snout bream (Megalobrama amblycephala)[J]. Journal of Fisheries of China, 1991, 15(3): 204-211. [李思发, 蔡完其, 周碧云. 团头鲂种群间的形态差异和生化遗传差异[J]. 水产学报, 1991, 15(3): 204-211.] |
| [19] |
Wang J L, Chen Q H, Lu W Z, et al. Morphological differences among five species in Rhodeinae in Huaihe River Basin in Henan Province[J]. Acta Hydrobiologica Sinica, 2019, 43(1): 123-132. [王景龙, 陈启豪, 陆文泽, 等. 河南省淮河流域鳑鲏亚科5种鱼形态差异分析[J]. 水生生物学报, 2019, 43(1): 123-132.] |
| [20] |
Wang D H. Multivariate Statistical Analysis and SPSS Application[M]. Shanghai: East China University of Science and Technology Press, 2010: 1-14. [汪冬华. 多元统计分析与SPSS应用[M]. 上海: 华东理工大学出版社, 2010: 1-14.]
|
| [21] |
Chapman A R O. The genetic basis of morphological differentiation in some Laminaria populations[J]. Marine Biology, 1974, 24(1): 85-91. DOI:10.1007/BF00402851 |
| [22] |
Cheverud J M. Phenotypic, genetic, and environmental morphological integration in the cranium[J]. Evolution, 1982, 36(3): 499-516. DOI:10.1111/j.1558-5646.1982.tb05070.x |
| [23] |
Dong Z G, Chang Y M. The main techniques and methods of fish germplasm identification[J]. Chinese Journal of Fisheries, 2002, 15(2): 74-77. [董志国, 常玉梅. 鱼类种质鉴定的主要技术与方法[J]. 水产学杂志, 2002, 15(2): 74-77.] |
| [24] |
Chen X W J, Guo J K, Yang Z, et al. Morphological differences among three wild populations of Siniperca kneri sampled from Guizhou Province[J]. Journal of Fishery Sciences of China, 2018, 25(1): 34-43. [陈薛伟杰, 郭健康, 杨志, 等. 贵州境内3个野生大眼鳜群体的形态差异[J]. 中国水产科学, 2018, 25(1): 34-43.] |
| [25] |
Pan Y Z, Liu H P, Zhu T B. Morphological variations between two wild groups of Glyptosternum maculatum in Tibet[J]. Journal of Fishery Sciences of China, 2019, 26(5): 823-833. [潘瑛子, 刘海平, 朱挺兵. 西藏黑斑原(鱼兆)两个野生群体的形态差异[J]. 中国水产科学, 2019, 26(5): 823-833.] |
| [26] |
Song W, Wang Y Z, Zhu D M, et al. Morphological variation and discriminant analysis of three geographical populations of freshwater bream Megalobrama skolkovii[J]. Chinese Journal of Fisheries, 2013, 26(4): 1-7. [宋文, 王艺舟, 祝东梅, 等. 三个地理种群鲂的形态差异与判别分析[J]. 水产学杂志, 2013, 26(4): 1-7.] |
| [27] |
Xu S Y, Zhang H, Liu B Z, et al. Morphological study of Sebastiscus marmoratus among populations in China and Japan[J]. Acta Hydrobiologica Sinica, 2013, 37(5): 960-966. [徐胜勇, 张辉, 柳本卓, 等. 中日褐菖鲉群体形态学比较研究[J]. 水生生物学报, 2013, 37(5): 960-966.] |
| [28] |
Wimberger P H. Plasticity of fish body shape. The effects of diet, development, family and age in two species of Geophagus (Pisces:Cichlidae)[J]. Biological Journal of the Linnean Society, 1992, 45(6): 197-218. |
| [29] |
Xia R S, Xu Z L. Nearly three years distribution characteristics of nutrient and its change trend in the Yangtze River Estuary and its adjacent waters[C]//Proceedings of the Academic Exchange Meeting of China Society of Fisheries Fishery Resources and Environment Branch, Zhoushan, 2013: 71-72. [夏荣霜, 徐兆礼.近三年长江口及其邻近海域营养盐分布特征及其变化趋势[C]//中国水产学会渔业资源与环境分会2013年学术交流会论文集, 舟山, 2013: 71-72.] http://cpfd.cnki.com.cn/Article/CPFDTOTAL-YYZY201311001038.htm
|
| [30] |
Liang S Z, Song W, Zhao M, et al. Morphology of seven Collichthys lucidus populations near the coast of the Yellow Sea and East China Sea[J]. Journal of Fishery Sciences of China, 2018, 25(3): 576-585. [梁述章, 宋炜, 赵明, 等. 黄海、东海近海七个棘头梅童鱼地理群体的形态差异分析[J]. 中国水产科学, 2018, 25(3): 576-585.] |
| [31] |
Du X X, Gao C X, Tian S Q, et al. Growth, mortality and optimum catchable size of Bombay duck (Harpadon nehereus) in the Wentai fishing ground, East China Sea[J]. Journal of Fisheries of China, 2018, 42(10): 1550-1558. [杜晓雪, 高春霞, 田思泉, 等. 温台渔场龙头鱼的生长、死亡及最适开捕规格[J]. 水产学报, 2018, 42(10): 1550-1558.] |
| [32] |
Ling Z H, Lei H Z. The growth of the head morphological traits of male and female Pseudobagrus fulvidraco[J]. Journal of Lishui Teachers College, 2004, 26(2): 39-41. [林植华, 雷焕宗. 雌雄两性黄颡鱼头部形态特征的增长[J]. 丽水师范专科学校学报, 2004, 26(2): 39-41.] |
| [33] |
Zhang X X, Zhu Q Y, Zhao J. Geometric morphometric analysis of body-form variability in populations of Tanichthys albonubes[J]. Journal of Fisheries of China, 2017, 41(9): 1365-1373. [张秀霞, 朱巧莹, 赵俊. 利用几何形态测量学方法分析唐鱼群体的形态变异[J]. 水产学报, 2017, 41(9): 1365-1373.] |
| [34] |
Wanghe K Y, Tang Y T, Li G G, et al. Geometric morphometrics of the cephalic contour and its morphological variations among Schizopygopsis stoliczkal (Teleostel:Cyprinidae)[J]. Acta Hydrobiologica Sinica, 2017, 41(1): 182-193. [王贺崐元, 汤永涛, 李国刚, 等. 高原裸裂尻鱼头部轮廓形状及其变异的几何形态测量分析[J]. 水生生物学报, 2017, 41(1): 182-193.] |
| [35] |
Guo Y J, Yang T Y, Meng W, et al. The genetic structure of the Bombay duck (Harpaddon nehereus) based on mitochondrial Cyt b gene[J]. Acta Hydrobiologica Sinica, 2019, 43(5): 945-952. [郭易佳, 杨天燕, 孟玮, 等. 基于线粒体Cyt b基因的龙头鱼群体遗传结构分析[J]. 水生生物学报, 2019, 43(5): 945-952.] |
| [36] |
Gao T X, Sun X F, Song N. Morphological variation analysis of seven populations of Synechogobius ommaturus[J]. Periodical of Ocean University of China, 2009, 39(1): 35-42. [高天翔, 孙希福, 宋娜. 斑尾复鰕虎鱼群体的形态学比较[J]. 中国海洋大学学报(自然科学版), 2009, 39(1): 35-42.] |
| [37] |
Chen C J, Yan B L, Gao T X. Morphological variation of redlip mullet (Liza haematocheilus) in different geographical populations along China coast[J]. Periodical of Ocean University of China, 2012, 42(Z2): 90-97. [陈澄璟, 阎斌伦, 高天翔. 中国沿海梭鱼群体的形态学比较研究[J]. 中国海洋大学学报(自然科学版), 2012, 42(Z2): 90-97.] |
| [38] |
Cheng Q Q, Lu D R, Ma L. Morphological differences between close populations discernible by multivariate analysis:A case study of genus Coilia (Teleostei:Clupeiforms)[J]. Aquatic Living Resources, 2005, 18(2): 187-192. DOI:10.1051/alr:2005020 |
| [39] |
Wayne R K. On the use of morphologic and molecular genetic characters to investigate species status[J]. Conservation Biology, 1992, 6(4): 590-592. DOI:10.1046/j.1523-1739.1992.06040590.x |
| [40] |
O'Brien S J, Mayr E. Bureaucratic mischief:Recognizing endangered species and subspecies[J]. Science, 1991, 251(4998): 1187-1188. DOI:10.1126/science.251.4998.1187 |
 2020, Vol. 27
2020, Vol. 27

