2. 上海海洋大学水产种质资源发掘与利用教育部重点实验室, 上海 201306;
3. 上海海洋大学海洋生物科学国际联合研究中心, 上海 201306;
4. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China;
3. International Research Center for Marine Biosciences at Shanghai Ocean University, Ministry of Science and Technology, Shanghai 201306, China;
4. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
在鱼类繁殖生物学的研究过程中, 卵巢发育及卵子发生是极为重要的研究内容。了解鱼类的卵巢发育特征从而确定其产卵类型, 对于开展资源调查、种群结构、人工繁育及种质资源保护等研究都具有十分重要的意义。鱼类卵巢的外部特征和组织学结构, 伴随年龄、季节的变化及性周期的运转而发生相应的变化, 国内外学者先后对鱼类的卵巢发育过程在组织学、组织化学、细胞学及超微结构等方面开展了大量研究[1-5]。目前, 关于鱼类卵子发生过程、卵巢发育分期及产卵类型的划分等尚无统一标准。中国学者普遍都是综合前人的观点并结合卵巢发育的实际情况, 将其发育过程划分为Ⅰ~Ⅵ时期, 每一时期与卵母细胞的时相对应[6]。根据卵巢发育和卵母细胞发育特点, 可以判断其产卵类型。据此, 中国学者将卵巢发育分为完全同步型、部分同步型和不同步型[8-9]; 而产卵类型则一般根据卵巢发育类型相应的划分为两种:一次产卵类型和多次分批产卵类型[7]。鱼类卵巢发育及卵子发生的形态学、组织学和超微结构等在四川华鳊(Sinibrama taeniatus)[1]、布氏罗非鱼(Tilapia buttikoferi)[2]、黑鱾(Girella leonina)[3]、高眼鲽(Cleisthenes herzensteini)[4]、广东鲂(Megalobrama terminalis) [10]、鲻(Mugil cephalus)[11]等多数硬骨鱼类已有较多研究报道。
四指马鲅(Eleutheronema tetradactylum)隶属于鲻形目(Mugiliformes), 马鲅亚目(Polynemoidei), 马鲅科(Polynemidae), 四指马鲅属(Eleutheronema), 俗名为马友、午笋、午鱼等[12]。四指马鲅为中上层浅海鱼类, 分布在热带、亚热带和温带沿海水域, 印度–西太平洋为主要分布地区, 波斯湾、新几内亚、澳大利亚、印度、日本、越南、东南亚及中国沿海均有分布[13-14]。四指马鲅具有肉质鲜、生长快、营养高等特点, 深受人们喜爱, 养殖前景广阔, 是我国重要的渔业资源和优良养殖品种。四指马鲅作为一种新开发的养殖经济鱼类, 近年来主要在种群结构[14-16]、遗传多样性[17]、寄生虫病害[18]、养殖生物学[19]、发育生物学[20-23]等方面有较多的研究。但是关于四指马鲅卵巢发育及卵子发生过程尚缺乏系统的研究资料, 近年来, Shihab等[24]对印度沿海的四指马鲅野生群体的雌雄同体性腺和卵巢做了初步的形态观察和组织学研究, 但鲜有养殖四指马鲅卵巢发育过程的研究报道。本研究基于课题组近几年来对四指马鲅的研究及调查资料, 运用组织切片显微摄影技术对其卵巢发育和卵子发生过程进行观察, 旨在确定四指马鲅卵巢发育类型和产卵类型, 了解其在人工养殖条件下的卵巢发育规律, 为提高人工繁育技术和开展种质资源保护研究提供理论依据, 从而完善四指马鲅的繁殖生物学资料。
1 材料与方法 1.1 实验材料实验用四指马鲅雌鱼为课题组于2015―2019年采集自广东省珠海市和中山市的池塘养殖群体。养殖盐度为5.0~9.0, 水温为24.0~30.0 ℃。共采集到雌鱼76尾, 体重56.72~1150.00 g, 体长17.52~42.30 cm。
1.2 实验方法将采集到的四指马鲅活体进行形态性状及体重测量后立即解剖, 观察卵巢的解剖结构, 记录卵巢发育过程中的形态特征及色泽变化。将卵巢取出, 整体或分别剪取前、中、后各一小段将其置于4%多聚甲醛通用型组织固定液(BL539A)固定24 h后, 转至70%酒精中保存。将固定的样品进行50%~100%梯度乙醇脱水, 二甲苯透明, 石蜡包埋, 以3~5 μm的厚度做横切, 苏木精–伊红(hematoxylin-eosin, HE)染色, 中性树脂封片, 在ZEISS型显光学微镜下观察并采集图像分析。卵巢分期和卵母细胞时相的划分以刘筠[7]和楼允东[9]的分期方法为主, 并参考滕广亮等[4]和朱亮华等[3]。采用Image-Pro Plus 6.0图像分析软件对各时相卵母细胞进行大小测量和比例统计, 根据在四指马鲅卵巢横切面上面积占比最大的卵母细胞的时相确定卵巢发育的时期。以50.00 μm为分组间距统计卵径分布情况, 各组统计包括组下限的卵母细胞不包括组上限的卵母细胞。
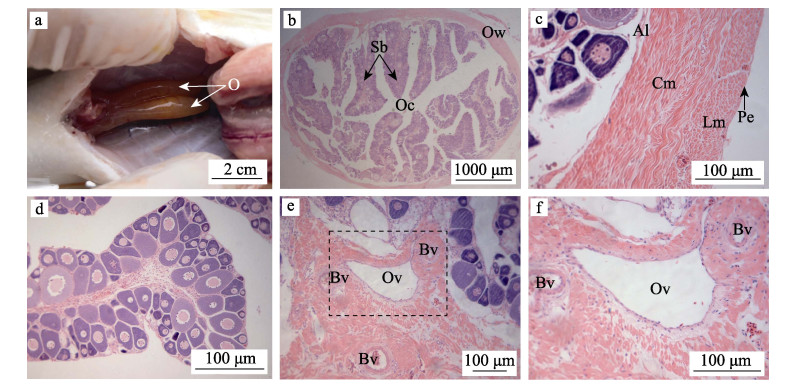
2 结果与分析 2.1 卵巢的组织结构特征四指马鲅雌性个体具一对被膜型卵巢, 位于中肾和鳔的腹面, 消化道背侧; 卵巢左右两侧大小无明显区别, 前端由被膜独立分开, 在后端靠近生殖孔处汇集融合, 呈“Y”字形; 早期卵巢为灰白色或浅黄色的短棒状, 随着发育的进行逐渐变为半透亮黄色圆柱状或囊状(图 1a)。
|
图 1 四指马鲅卵巢组织结构
a:卵巢解的剖结构; b:卵巢横切面; c:卵巢壁; d:产卵板; e:输卵管和血管; f: e的放大. Al:白膜; Bv:血管; Cm:环肌; Lm:纵肌; O:卵巢; Oc:卵巢腔; Ow:卵巢壁; Ov:输卵管; Pe:腹膜; Sb:产卵板. Fig.1 The histological structure of ovary in Eleutheronema tetradactylum a: the anatomical structure of ovary; b: the cross-section of ovary; c: the ovary wall; d: spawning board; e: oviduct and blood vessel; f: the amplification of e. Al: albuginea; Bv: blood vessel; Cm: circular muscle; Lm: longitudinal muscle; O: ovary; Oc: ovarian cavity; Ow: ovary wall; Ov: oviduct; Pe: peritoneum; Sb: spawning board. |
卵巢横切面多为圆形或椭圆形, 由卵巢壁、卵巢腔和产卵板组成(图 1b); 卵巢壁由外到内依次为腹膜、纵肌、环肌、白膜, 环肌较纵肌厚, 白膜向卵巢腔延伸构成指状或形态不规则的板层结构, 即产卵板(图 1c); 产卵板边缘为生殖上皮, 有卵原细胞分布, 中央为结缔组织, 有较多的毛细血管(图 1d); 输卵管周边有较多的动脉和静脉等血管分布, 管壁肌肉层较发达(图 1e, 图 1f)。
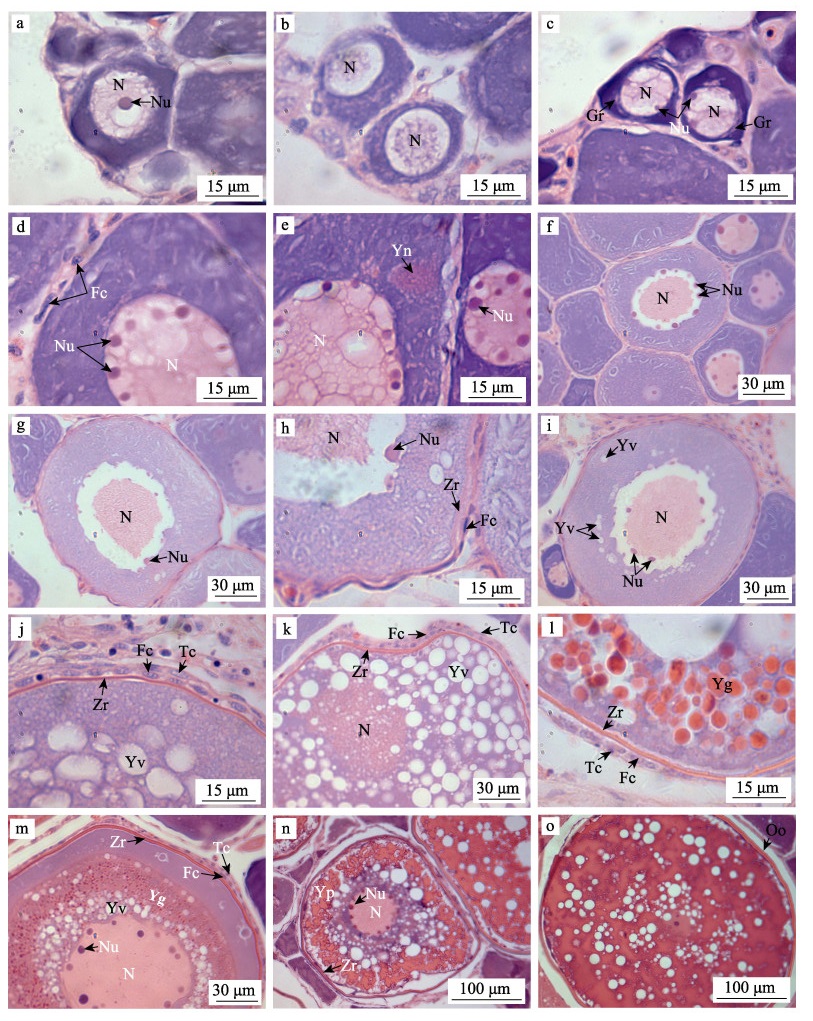
2.2 卵子发生过程四指马鲅卵母细胞由卵原细胞分裂, 在产卵板上发育形成。根据卵母细胞及其细胞核的直径大小、核仁分布、滤泡膜组成变化及卵黄物质的积累特征等, 可将卵母细胞发育过程分为5个时相。
2.2.1 第Ⅰ时相(卵原细胞)第Ⅰ时相为卵原细胞及其向初级卵母细胞过渡期, 多分布在产卵板边缘的生殖上皮或初级卵母细胞周围。卵原细胞多为圆形或椭圆形, 细胞界限模糊, 细胞质嗜碱性较强, 呈蓝紫色, 细胞核大而明显, 核内染色质浅紫色呈网状分布, 核内具中央大核仁(图 2a), 胞径为6.60~40.86 μm, 核径为4.42~19.17 μm。处于有丝分裂中的卵原细胞, 核膜及中央大核仁消失, 核内染色质呈絮状零散分布(图 2b)。
|
图 2 四指马鲅的卵子发生过程 a:第Ⅰ时相, 示中央大核仁; b:第Ⅰ时相, 示有丝分裂; c:第Ⅱ时相早期, 示核周小核仁和生长环; d:第Ⅱ时相中期, 示滤泡细胞; e:第Ⅱ时相中期, 示卵黄核; f:第Ⅱ时相中期, 示核质间隙; g:第Ⅱ时相晚期; h:第Ⅱ时相晚期, 示放射带和滤泡细胞层; i:第Ⅲ时相早期, 示卵黄泡; j:第Ⅲ时相中期, 示鞘膜细胞层; k:第Ⅲ时相晚期, 示卵黄泡增多; l:第Ⅳ时相早期, 示卵黄颗粒; m:第Ⅳ时相中期, 示卵黄颗粒增多; n:第Ⅳ时相晚期, 示卵黄小板; o:成熟卵子。Fc:滤泡细胞; Gr:生长环; N:细胞核; Nu:核仁; Oo:卵膜; Tc:鞘膜细胞; Yg:卵黄颗粒; Yv:卵黄泡; Yn:卵黄核; Yp:卵黄小板; Zr:放射带. Fig.2 The process of oogenesis in Eleutheronema tetradactylum a: first phase, showing the nucleolus; b: first phase, showing mitosis; c: early phase 2, showing the perinuclear nucleoli and growth ring; d: medium phase 2, showing the follicle cells; e: medium phase 2, showing the yolk nucleus; f: medium phase 2, showing the nucleus-cytoplasm gap; g: late phase 2; h: late phase 2, showing the zona radiate and follicular cell layer; i: early phase 3, showing the yolk vacuole; j: medium phase 3, showing the thecal cell layer; k: late phase 3, showing the yolk vacuole increasing; l: early phase 4, showing the yolk granule; m: medium phase 4, showing the yolk granule increasing; n: late phase 4, showing the yolk platelet; o: mature oocyte. Fc: follicle cell; Gr: growth ring; N: nucleus; Nu: nucleolus; Oo: oolemma; Tc: thecal cell; Yv: yolk vacuole; Yg: yolk granule; Yn: yolk nucleus; Yp: yolk platelet; Zr: zona radiate. |
第Ⅱ时相为初级卵母细胞形成到胞外滤泡细胞层完全形成, 该阶段为卵母细胞小生长期, 历时较长, 细胞体积明显增大, 胞径为15.04~153.35 μm, 核径为11.86~42.24 μm, 细胞着色变化明显, 小核仁数量增加, 多分布在细胞核外侧。
早期的Ⅱ时相卵母细胞为卵原细胞分裂形成, 体积比卵原细胞稍大, 圆形或不规则形, 细胞质嗜碱性较强, 核内无中央大核仁, 紧贴核膜内缘有2~3个小核仁分布, 均嗜碱性, 呈蓝紫色, 细胞核内染色质仍为强嗜碱性絮状, 细胞质中出现生长环, 弱嗜碱性, 呈浅紫色(图 2c)。
中期的Ⅱ时相卵母细胞多分布在产卵板的中部, 细胞切面呈卵圆形或不规则多边形, 细胞质嗜碱性增强, 呈深紫色, 细胞核着色加深, 呈紫红色, 核质较均匀, 核膜内缘小核仁增加至7~9个, 卵母细胞周围有滤泡细胞开始形成, 细胞扁平状, 强嗜碱性, 呈蓝紫色, 紧贴卵母细胞(图 2d); 部分卵母细胞的细胞质中可观察到卵黄核, 呈紫红色, 为无膜包裹的团块状(图 2e); 部分卵母细胞出现无染色的核质间隙, 核仁外移至核膜外侧(图 2f)。
晚期的Ⅱ时相卵母细胞嗜碱性减弱, 呈浅紫色, 体积明显增大, 切面逐渐变为圆形或椭圆形, 核质间隙逐渐增大, 核仁多位于核膜外侧(图 2g); 此阶段卵母细胞外周的单层扁平滤泡细胞完全形成, 紧贴细胞膜呈环状分布, 滤泡细胞层和卵母细胞之间出现放射带, 弱嗜酸性, 呈粉红色(图 2h)。
2.2.3 第Ⅲ时相(卵黄泡出现)第Ⅲ时相卵母细胞体积进一步增大, 开始进入大生长期, 细胞直径为52.09~279.47 μm, 核径为32.06~99.22 μm, 细胞核占比减小。此阶段细胞质逐渐由弱嗜碱性向弱嗜酸性转变, 以卵黄泡的出现作为进入该阶段的标志, 另外鞘膜细胞开始形成。
早期的第Ⅲ时相卵母细胞弱嗜碱性, 呈浅紫色, 核质间隙较大。细胞质中开始出现卵黄泡, 卵黄泡为椭圆形小空泡, 不着色, 可认为无内容物填充, 多分布在靠近细胞核周围, 靠近细胞膜一侧亦有少许分布(图 2i)。细胞质中的卵黄核消失, 细胞核内有数个小核仁, 核膜波曲不明显。放射带仍为弱嗜酸性, 着色较浅。
中期的第Ⅲ时相卵母细胞卵黄泡增加, 逐渐填充细胞质外侧, 细胞质着色加深, 呈紫色, 细胞核着色不变, 核仁个数有所减少, 核质间隙消失, 核膜不明显。此阶段卵母细胞周围的滤泡细胞外层形成一层鞘膜细胞, 强嗜碱性, 呈深紫色, 扁平长梭形, 较滤泡细胞小, 放射带逐渐变成嗜碱性, 呈红色, 分两层, 着色差异不大但界限明显(图 2j)。
晚期的第Ⅲ时相卵母细胞卵黄泡明显增多, 几乎布满细胞质, 少数卵黄泡内有嗜酸性物质, 卵黄泡之间有少许卵黄颗粒形成, 细胞核缩小, 核仁数量减少, 核膜不清晰, 少数滤泡细胞由扁平状逐渐变成立方形, 放射带无明显变化(图 2k)。
2.2.4 第Ⅳ时相(卵黄充满)第Ⅳ时相卵母细胞处于大生长期后期阶段, 卵黄颗粒开始填充卵黄泡形成卵黄脂滴并逐渐板结成块状的卵黄小板, 细胞体积进一步增大, 细胞直径为124.02~436.90 μm, 核径为46.80~137.84 μm。
早期的第Ⅳ时相卵母细胞体积增大, 圆形或椭圆形, 细胞核着色变浅, 核仁位于核膜内侧, 细胞质外缘的卵黄颗粒聚集成大颗粒状开始填充卵黄泡, 卵黄颗粒强嗜酸性, 呈橘红色, 放射带增厚, 滤泡细胞变成立方形, 鞘膜细胞仍为扁平梭形(图 2l)。
中期的第Ⅳ时相卵母细胞卵黄颗粒逐渐填充卵黄泡, 至细胞核附近均被染成红色, 呈一大圆环, 细胞核弱嗜碱性, 呈粉红色, 核仁个数较多, 均分布于核膜内侧, 核膜锯齿状, 界限清晰, 放射带颜色加深, 呈火红色, 滤泡细胞层和鞘膜细胞层无明显变化(图 2m)。
晚期的第Ⅳ时相卵母细胞卵黄泡逐渐减少, 仅在细胞核附近分布有卵黄泡, 卵黄颗粒逐渐板结连成形成卵黄小板, 强嗜碱性, 呈深红色, 几乎充满整个细胞质, 细胞核被挤压而明显缩小并逐渐移向一侧, 核内仍有数个核仁, 分布于核膜内侧, 放射带增厚, 颜色加深, 呈紫红色, 滤泡细胞变回扁平状, 鞘膜细胞层极薄(图 2n)。
2.2.5 第Ⅴ时相(成熟卵子)第Ⅴ时相卵母细胞为成熟卵子, 其切面为圆形, 直径为348.02~462.84 μm; 细胞核溶解, 细胞外围无滤泡细胞层及鞘膜细胞层包裹; 此时脱离产卵板落入卵巢腔中, 呈游离状态; 卵膜较厚, 呈橘黄色, 与卵质区分明显; 卵质内卵黄小板连成片状并相互融合, 强嗜碱性, 呈深红色(图 2o)。
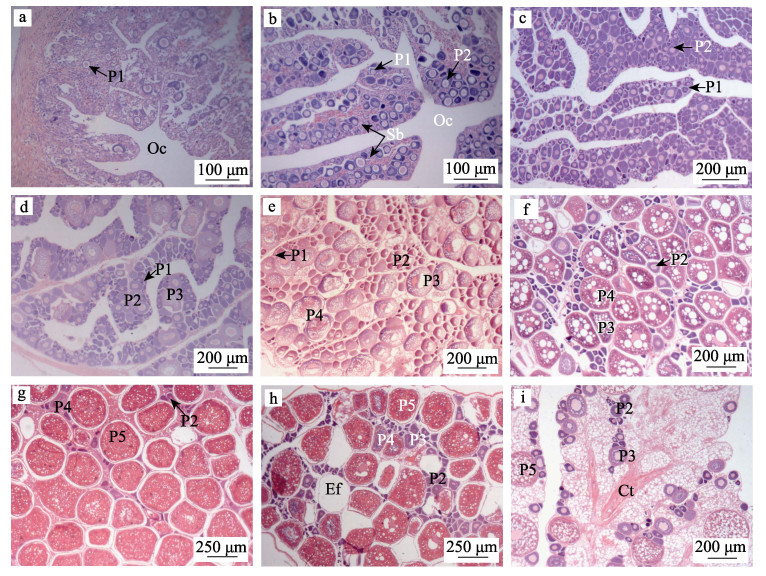
2.3 卵巢发育组织学特征根据四指马鲅卵巢的解剖学特征、各时相卵母细胞的数量和面积占比变化, 并参照常用的硬骨鱼类性腺发育分期方法, 可将其卵巢发育过程分为6期(Ⅰ, Ⅱ, Ⅲ, Ⅳ, Ⅴ, Ⅵ)。
2.3.1 第Ⅰ期Ⅰ期卵巢细线状, 紧贴中肾腹侧, 呈灰白色, 从外观上不能与精巢区分。早期组织学观察发现卵巢腔出现, 标志着卵巢分化形成, 此时尚未形成明显的产卵板, 卵巢壁较薄, 内部有卵原细胞成簇分布, 嗜碱性较强, 呈紫色(图 3a)。晚期嗜碱性增强, 产卵板完全形成, 呈指状向卵巢腔延伸, 卵原细胞逐渐增多, 多分布在产卵板边缘, 有少量早期的Ⅱ时相卵母细胞形成(图 3b)。
|
图 3 四指马鲅卵巢发育组织学特征
a, b: Ⅰ期; c, d: Ⅱ期; e: Ⅲ期; f: Ⅳ期; g, h: Ⅴ期; i: Ⅵ期. Ct:结缔组织; Ef:空滤泡; Oc:卵巢腔; P1:第Ⅰ时相卵母细胞; P2:第Ⅱ时相卵母细胞; P3:第Ⅲ时相卵母细胞; P4:第Ⅳ时相卵母细胞; P5:第Ⅴ时相卵母细胞; Sb:产卵板. Fig.3 The histological feature of ovarian development in Eleutheronema tetradactylum a, b: stage I; c, d: stage Ⅱ; e: stage Ⅲ; f: stage Ⅳ; g, h: stage V; i: stage Ⅵ. Ct: connective tissue; Ef: empty follicle; Oc: ovarian cavity; P1: first phase oocyte; P2: phase 2 oocyte; P3: phase 3 oocyte; P4: phase 4 oocyte; P5: phase 5 oocyte; Sb: spawning board. |
该时期卵巢主要由卵原细胞和早期Ⅱ时相卵母细胞组成, 其中卵原细胞占大多数, 为79.12%, 面积占比为69.73%, 早期的Ⅱ时相卵母细胞占20.88%, 面积占比为30.27% (图 4a); 此时卵径均小于50 μm, 主要分布在6.60~40.863 μm范围(图 4b)。
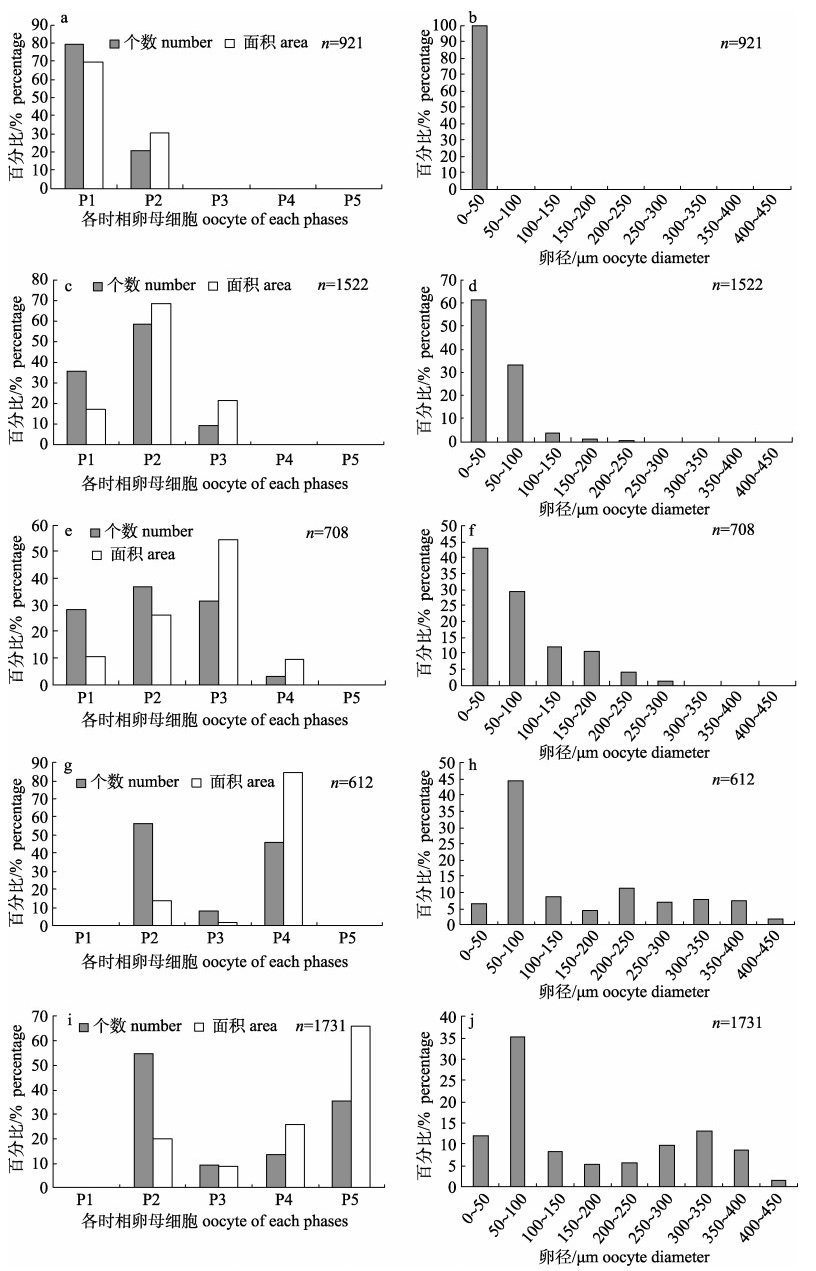
|
图 4 四指马鲅不同时期卵巢各时相卵母细胞数量及面积占比和卵径分布特征 a, b: Ⅰ期; c, d: Ⅱ期; e, f: Ⅲ期; g, h: Ⅳ期; i, j: Ⅴ期. Fig.4 The proportion of the number and area of oocytes in each phases, and oocyte size distribution in different stages of ovary in Eleutheronema tetradactylum a, b: stage I; c, d: stage Ⅱ; e, f: stage Ⅲ; g, h: stage Ⅳ; i, j: stage V. |
Ⅱ期卵巢短棒状, 呈透亮黄色, 表面出现毛细血管, 外观上与精巢区别明显。早期嗜碱性增强, 呈深紫色, 产卵板延伸布满卵巢腔, 多有分叉交错, 卵原细胞沿产卵板外缘有规则排列, 中部有大量Ⅱ时相卵母细胞形成(图 3c)。晚期嗜碱性减弱, 呈浅紫色, 产卵板面积增大, 多有分叉, 中部出现空白间隙, 有少量Ⅲ时相卵母细胞形成(图 3d)。
该时期主要以Ⅱ时相卵母细胞为主, 其数量占比增加至58.2%, 面积占比为68.54%;卵原细胞个数减少至35.65%, 面积占比为17.3%; Ⅲ时相卵母细胞占比为9.23%, 面积占比为21.50% (图 4c)。卵径呈单峰分布, 分布范围明显扩大, 在6.60~247.47 μm之间, 其中6.60~50.00 μm所占比例最高, 为61.70%, 其次为50.00~100.00 μm, 占33.51% (图 4d)。
2.3.3 第Ⅲ期Ⅲ期卵巢为饱满指状, 呈透亮金黄色, 表面毛细血管增加, 多有分支, 呈网状分布, 卵巢内可见卵粒, 不易剥离。卵巢切片嗜碱性减弱, 呈紫红色, 产卵板之间几乎连成片状, 边缘有少数卵原细胞, 中部主要为Ⅱ时相和Ⅲ时相卵母细胞, 已有少数早期Ⅳ时相卵母细胞形成, 其切面多为圆形或椭圆形(图 3e)。
该时期Ⅲ时相卵母细胞个数明显增加, 占比为31.68%, 其面积占主要优势, 为54.21%; Ⅱ时相卵母细胞占36.63%, 面积为25.91%;卵原细胞占28.45%, 面积为10.32%, Ⅳ时相卵母细胞仅占3.23%, 面积占比为9.55% (图 4e)。卵径仍呈单峰分布, 范围在10.05~269.38 μm之间, 其中10.05~50.00 μm占42.89%, 50.00~100.00 μm占29.49%, 大于100.00 μm占27.62% (图 4f)。
2.3.4 第Ⅳ期Ⅳ期卵巢体积明显增大, 为囊状, 呈暗黄色, 表面血管网丰富, 卵巢内卵粒明显, 较易剥离。卵巢切片嗜碱性较弱, 呈紫红色, 同时存在Ⅰ、Ⅱ、Ⅲ、Ⅳ时相的卵母细胞, 互相交错分布, 产卵板间无明显界限(图 3f)。
该时期以Ⅱ时相和Ⅳ时相卵母细胞为主, 分别占56.09%和45.63%, Ⅳ时相卵母细胞面积占比为84.78%, 占绝对优势(图 4g)。卵径分布范围扩大到30.40~462.84 μm, 呈小双峰分布, 在50.00~ 100.00 μm间为高峰, 占44.61%, 在200.00~ 250.00 μm间为低峰, 占11.44% (图 4h)。
2.3.5 第Ⅴ期Ⅴ期卵巢为极度膨大囊状, 占满腹腔, 呈橘黄色, 表面血管网发达, 轻压腹部有透亮的浅黄色卵子排出。组织切片着红色, 大量成熟卵子充满卵巢腔, 此外还存在较多的Ⅱ时相和Ⅳ时相卵母细胞, 卵原细胞和Ⅲ时相卵母细胞少见有分布(图 3g)。卵巢成熟经第一次产卵后体积有所减小, 呈松弛囊状, 表面血管丰富; 卵巢内结缔组织增多, 卵巢腔间隙变大, 主要以各阶段的Ⅱ时相和Ⅳ时相卵母细胞为主, 细胞排列疏松, 中间可见较多空滤泡以及泡沫状的退化卵, 该时期停留时间较短; 随后再次成熟, 进行二次产卵, 此时Ⅱ时相和Ⅴ时相卵母细胞较多, 细胞间排列疏松, 同时Ⅲ时相和Ⅳ时相卵母细胞增多, 其中有较多的空滤泡和明显的产卵痕迹(图 3h)。
该时期主要以Ⅱ时相和Ⅴ时相卵母细胞为主, 分别占54.60%和35.41%, 但Ⅴ时相卵母细胞的面积占比远高于Ⅱ时相卵母细胞, 为66.16%, Ⅱ时相卵母细胞面积占比只有19.98% (图 4i)。卵径分布范围进一步扩大, 在37.88~462.84 μm范围呈双峰分布, 在50.00~100.00 μm和300.00~350.00 μm出现峰值(图 4j)。
2.3.6 第Ⅵ期繁殖期过后, 经完全产卵后的卵巢进入Ⅵ期, 卵巢萎缩, 呈干瘪囊状, 暗红色, 表面血管发达。卵巢内部结缔组织和血管增多, 卵巢腔缩小, 产卵板片状, 边缘有Ⅱ时相卵母细胞有规则排列, 中部有少量早期Ⅲ时相卵母细胞, 未排出的Ⅴ时相卵母细胞逐渐被消化吸收, 呈空泡化连成网状(图 3i)。
3 讨论 3.1 四指马鲅的卵巢结构鱼类卵巢一般成对分布在腹腔的肠系膜背侧和中肾腹侧, 但是在多数卵胎生鱼类只有一个被膜型的卵巢[25-27]。本研究结果表明, 四指马鲅具一对卵巢, 前端左右分离, 后端融合, 呈“Y”字形, 表面血管网丰富, 与大多数体外受精的硬骨鱼类相似。组织切片观察显示, 四指马鲅卵巢横切面为圆形或椭圆形, 从外到内依次为腹膜层、肌肉层、白膜及生殖上皮等组成。腹膜层较薄, 与肠系膜类似, 为结缔组织; 肌肉层有两层, 呈外环内纵分布, 纵肌明显比环肌厚, 具有较强的收缩性, 这样更有利于发育过程中体积的增大; 白膜层由结缔组织、肌纤维和血管等组成, 该层的生殖上皮向卵巢腔突起延伸, 形成大小不一的指状产卵板。卵巢腔是成熟卵子的主要贮存场所, 一般认为卵巢腔的出现是卵巢分化形成的标志[28]。输卵管是生殖系统的重要组成部分, 四指马鲅输卵管的汇合处前端紧贴着卵巢壁, 有一小口与卵巢腔相接, 其周围有较多的血管分布, 以提高血氧供应, 保证产卵的顺利进行。这与布氏罗非鱼[2]、松江鲈(Trachidercnus fasciatus)[29]、广东鲂[10]、高眼鲽[4]等大多数硬骨鱼类基本相同。但与剑尾鱼(Xiphophorus helleri)[25]、食蚊鱼(Gambusia affinis)[26]、褐菖鲉(Sebastiscus marmoratus)[27]等卵胎生鱼类的卵巢在组织学上具有明显的区别。
3.2 四指马鲅的卵子发生特点四指马鲅的卵原细胞有两种形态, 卵原细胞早期核质比较高, 嗜碱性强, 具中央大核仁, 后期进行有丝分裂时核膜、核仁逐渐溶解消失, 只见细胞核内染色质呈网状分布, 将这两种类型的卵原细胞划分为第Ⅰ时相, 这与四川华鳊、高眼鲽的研究结果类似[1, 4]。在进入Ⅱ时相时, 卵母细胞在细胞核内侧出现若干小核仁, 此时卵母细胞呈弱嗜碱性, 一般将其划分为Ⅱ时相的早期, 并作为进入小生长期的标志[1]。在Ⅱ时相中期, 卵母细胞边缘开始出现滤泡细胞, 滤泡细胞在卵子发生过程中具有分生增殖的功能, 在卵母细胞退化时, 滤泡细胞可分化出巨噬细胞将退化的卵母细胞进行消化吸收[26, 31]。本研究发现, 四指马鲅卵母细胞在Ⅱ时相晚期只有一层滤泡细胞, 而在Ⅲ时相中期分化成两层, 外层为鞘膜细胞, 内层为颗粒细胞, 与四川华鳊[1]、黑鱾[3]、犬首鮈(Gobio cynocephalus)[31]、金钱鱼(Scatophagus argus)[32]等的研究结果类似。四指马鲅部分卵母细胞在Ⅱ时相中期在细胞质边缘有卵黄核形成, 在Ⅲ时相消失, 这与四川华鳊[1]、长鳍吻鮈(Rhinogobio ventralis)[5]、剑尾鱼[27]等多数硬骨鱼类一致。大量研究表明, 卵黄核内部主要为线粒体、高尔基体和内质网等, 可为卵黄物质的积累提供能量, 并参与卵黄小板的形成, 但关于其形成和迁移机制尚不明确, 需要进一步研究[1, 33]。
鱼类卵子发生过程中卵黄物质的积累备受关注, 四指马鲅在Ⅲ时相卵母细胞早期开始在细胞质的外侧和细胞核附近开始出现卵黄泡, 直到晚期结束卵黄泡充满卵母细胞的细胞质, 而在Ⅳ时相早期卵母细胞的细胞质外侧出现卵黄颗粒开始充满卵黄泡并逐渐形成脂滴状, 在晚期时板结成卵黄小板连成片状几乎布满细胞质, 这与犬首鮈[31]、圆斑星鲽(Verasper variegates)[34]、半滑舌鳎(Cynoglossus semilaevis)[35]等相似, 不同的是四指马鲅在Ⅲ时相晚期就在卵黄泡之间有少许卵黄颗粒形成。张贤芳等[33]研究发现, 圆口铜鱼(Coreius guichenoti)的卵黄泡最早在Ⅱ时相晚期卵母细胞的细胞膜附近出现, 并向细胞核逐渐填充, 在卵黄泡出现的同时, 卵黄颗粒随即出现在细胞质边缘; 四川华鳊在当卵黄泡积累至3~5层时, 嗜酸性卵黄物就开始大量积累于卵黄泡内, 卵黄泡与卵黄物质的出现呈此消彼长的发育模式[1]; 高眼鲽的卵母细胞则先出现卵黄, 随后出现卵黄泡[4]; 欧洲黄盖鲽(Limanda limanda)在卵子的发生过程中, 卵黄泡、脂滴和卵黄颗粒等卵黄物质是同时出现的[36]; 金钱鱼的卵黄物质出现顺序是先油滴(脂肪泡)后卵黄球[32]。由此可见, 在不同的鱼类中卵黄泡及卵黄颗粒出现的时间和位置有所不同, 这与营养吸收方式不同有关, 同时遗传物质及长期环境影响不同使得鱼类卵母细的发育和生长有一定的差异[37]。
3.3 四指马鲅的卵巢发育及产卵类型卵巢的发育分期综合各时相卵母细胞数量和面积占比及其发育的自身特点对其发育过程进行分期。林鼎等[30]按卵细胞形态结构和其不同时相在卵巢中的主次结构将日本鳗鲡(Anguilla japonica)的卵巢发育归纳为卵原细胞期、单层滤泡期、脂肪泡期、卵黄充满期、核极化期和退化期等6期。本研究参考滕广亮等[4]和朱亮华等[3]对高眼鲽和黑鱾卵巢发育时期的划分方法, 根据在卵巢横切面上面积占比最大的时相卵母细胞及卵巢发育特点将四指马鲅卵巢发育过程分成6个时期, 与大多数硬骨鱼类一致。
根据卵母细胞的发育特点, 一般将鱼类卵巢发育分为3种类型:完全同步型、部分同步型和不同步型[8]; 产卵类型一般分为两种:一次产卵类型和多次产卵类型[7]。本研究发现, 四指马鲅卵巢在Ⅱ期时就同时存在Ⅰ、Ⅱ、Ⅲ时相的卵母细胞, 此时Ⅲ时相的卵母细胞占比相对较少, 开始表现出发育的不同步性; Ⅲ期时Ⅲ时相卵母细胞个数明显增加(31.68%), 其面积占主要优势(54.21%), 此外还有较多的Ⅱ时相卵母细胞(36.63%)和卵原细胞(28.45%), 可见该期各时相卵母细胞数量占比相近, 仅有一小批卵母细胞优先往前发育; Ⅳ期时以Ⅱ时相和Ⅳ时相卵母细胞为主, 分别占56.09%和45.63%, 卵径分布开始出现一大一小的峰值而呈双峰分布; Ⅴ期主要以Ⅱ时相和Ⅴ时相的卵母细胞为主, 卵径呈明显双峰分布。四指马鲅卵巢经Ⅴ期成熟产卵后, 卵巢中仍存在大量的Ⅱ时相和Ⅳ时相的卵母细胞, 其中Ⅳ时相卵母细胞的面积占比占绝对优势, 该组织特征表明, 四指马鲅不久后将会进行再一次产卵; 四指马鲅在进行二批或多批产卵时卵巢中成熟卵子排列较首次疏松且有明显的产卵痕迹; 经产卵结束后的卵巢无Ⅳ时相卵母细胞, 只有少数早期Ⅲ时相和Ⅱ时相卵母细胞存在。这与布氏罗非鱼[2]、高眼鲽[4]、金钱鱼[32]等的研究结果类似。据此, 可判断四指马鲅卵巢发育模式为非同步发育, 产卵类型属分批产卵类型。根据实际生产经验, 四指马鲅亲鱼的繁殖期一年只出现一次, 5—9月为产卵期。
| [1] |
Yin M, Xie C Y, Pu D Y, et al. Microstructure of oogenesis in Sinibrama taeniatus[J]. South China Fisheries Science, 2019, 15(2): 27-132. [尹敏, 解崇友, 蒲德永, 等. 四川华鳊卵子发生的显微结构观察[J]. 南方水产科学, 2019, 15(2): 27-132.] |
| [2] |
Liu Y, Zhao T T, Hu Y C, et al. Histological studies on gonadal development of Tilapia buttikoferi[J]. Acta Agriculturae Universitatis Jiangxiensis, 2019, 41(2): 340-346. [刘奕, 赵婷婷, 胡隐昌, 等. 布氏罗非鱼性腺发育的组织学研究[J]. 江西农业大学学报, 2019, 41(2): 340-346.] |
| [3] |
Zhu L H, Sun M, Zhang D Y, et al. Histological study on the ovary development of Girella leonine[J]. Journal of Applied Oceanography, 2018, 37(2): 255-262. [朱亮华, 孙敏, 张鼎元, 等. 黑鱾卵巢发育的组织学研究[J]. 应用海洋学学报, 2018, 37(2): 255-262. DOI:10.3969/J.ISSN.2095-4972.2018.02.013] |
| [4] |
Teng G L, Shan X J, Jin X S, et al. A study on the ovary- development characters and oocyte size-distribution of Cleisthenes herzensteini in the Yellow Sea[J]. Progress in Fishery Sciences, 2018, 39(1): 12-20. [滕广亮, 单秀娟, 金显仕, 等. 黄海高眼鲽卵巢发育特征及卵径分布[J]. 渔业科学进展, 2018, 39(1): 12-20.] |
| [5] |
Qu H T, Liu Y, Yang Y J, et al. Histological change in annual development of ovary in gudgeon Rhinogobio ventralis[J]. Fisheries Science, 2015, 34(1): 32-37. [曲焕韬, 刘勇, 杨元金, 等. 长鳍吻鮈卵巢发育组织学及周年变化的初步研究[J]. 水产科学, 2015, 34(1): 32-37.] |
| [6] |
Shi Q F, Yin Y W. Study on the annual changes of gonadal in Hypophthalmichthys molitrix[J]. Acta Hydrobiologica Sinica, 1964, 5(2): 77-94. [施瑔芳, 尹伊伟. 鲢鱼性腺周年变化的研究[J]. 水生生物集刊, 1964, 5(2): 77-94.] |
| [7] |
Liu Y. Reproductive physiology of cultured fish in China[M]. Beijing: Agriculture Press, 1993: 22-32. [刘筠. 中国养殖鱼类繁殖生理学[M]. 北京: 农业出版社, 1993: 22-32.]
|
| [8] |
Lin H R. Fish Physiology[M]. Guangzhou: Guangdong Higher Education Press, 1999: 185-188. [林浩然. 鱼类生理学[M]. 广州: 广东高等教育出版社, 1999: 185-188.]
|
| [9] |
Lou Y D. Histoembryology(2nd Edition)[M]. Beijing: Agricultural Press of China, 1980: 131-137. [楼允东. 组织胚胎学(第二版)[M]. 北京: 中国农业出版社, 1980: 131-137.]
|
| [10] |
Liu Y Q, Li X H, Li Y F, et al. A histological study on gonadal development of black amur bream (Megalobrama terminalis)[J]. South China Fisheries Science, 2019, 15(1): 113-118. [刘亚秋, 李新辉, 李跃飞, 等. 广东鲂性腺发育组织学研究[J]. 南方水产科学, 2019, 15(1): 113-118.] |
| [11] |
Fang Y Q, Lin J Z, Weng Y Z, et al. The process of the ovary development and oogenesis in the cultured-pond Mugil cephalus[J]. Journal of Fisheries of China, 2004, 28(4): 353-359. [方永强, 林君卓, 翁幼竹, 等. 池养鲻的卵巢发育和卵子发生过程[J]. 水产学报, 2004, 28(4): 353-359.] |
| [12] |
Sun D R, Chen Z. South China Sea Fish Search[M]. Beijing: Ocean Press, 2013: 380-382. [孙典荣, 陈铮. 南海鱼类检索[M]. 北京: 海洋出版社, 2013: 380-382.]
|
| [13] |
Wang G H, Hao R C, Yang G Z, et al. The complete mitochondrial genome sequence of Eleutheronema tetradactylum (Mugiliformes: Polynemidae) and phylogenetic studies of Mugiliformes[J]. DNA Sequence, 2015, 27(6): 4457-4458. |
| [14] |
Wang J, Peng S, Fei Y. Low mtDNA Cytb diversity and shallow population structure of Eleutheronema tetradactylum in the East China Sea and the South China Sea[J]. Biochemical Systematics & Ecology, 2014, 55(2): 268-274. |
| [15] |
Wang G, Hao R, Yang G, et al. The complete mitochondrial genome sequence of Eleutheronema tetradactylum (Mugiliformes: Polynemidae) and phylogenetic studies of Mugiliformes[J]. Mitochondrial DNA Part A, 2016, 27(6): 4457-4458. DOI:10.3109/19401736.2015.1089569 |
| [16] |
Newman S J, Penber M B, Rome B M, et al. Stock structure of blue threadfin Eleutheronema tetradactylum across northern Australia as inferred from stable isotopes in sagittal otolith carbonate[J]. Fisheries Management and Ecology, 2011, 18: 246-257. DOI:10.1111/j.1365-2400.2010.00780.x |
| [17] |
Thirumaraiselvi R, Thangaraj M. Genetic diversity analysis of Indian salmon, Eleutheronema tetradactylum from south Asian countries based on mitochondrial COI gene sequences[J]. Notulae Scientia Biologicae, 2015, 7(4): 417-422. DOI:10.15835/nsb749668 |
| [18] |
Bharadhirajan P, Gopalakrishnan A, Raja K, et al. Prevalence of copepod parasite (Lernaeenicus polynemi) infestation on Eleutheronema tetradactylum from Pazhayar coastal waters, southeast coast of India[J]. Journal of Coastal Life Medicine, 2013, 1(4): 278-281. |
| [19] |
Xie M J, Ou Y J, Weng J F, et al. Salinity tolerance of fertilized eggs and larva of Eleutheronema tetradactylum[J]. Chinese Journal of Ecology, 2016, 35(5): 1263-1267. [谢木娇, 区又君, 温久福, 等. 四指马鲅(Eleutheronema tetradactylum)受精卵和仔鱼对不同盐度的耐受性[J]. 生态学杂志, 2016, 35(5): 1263-1267.] |
| [20] |
Zhou H, Li J E, Ou Y J, et al. Histological observation on the development of retina in fourfinger threadfin (Eleutheronema tetradactylum) larvae[J]. Chinese Journal of Zoology, 2017, 52(3): 458-467. [周慧, 李加儿, 区又君, 等. 四指马鲅视网膜早期发育的组织学研究[J]. 动物学杂志, 2017, 52(3): 458-467.] |
| [21] |
Xie M J, Ou Y J, Li J E, et al. Histological observation of the post-embryonic development of digestive tract of Eleutheronema tetradactylum[J]. Progress in Fishery Sciences, 2017, 38(2): 50-58. [谢木娇, 区又君, 李加儿, 等. 四指马鲅(Eleutheronema tetradactylum)消化系统胚后发育组织学观察[J]. 渔业科学进展, 2017, 38(2): 50-58.] |
| [22] |
Xie M J, Ou Y J, Weng J F, et al. Development law of mucous cell in digestive tract of Eleutheronema tetradactylum[J]. Journal of Southern Agriculture, 2016, 47(7): 1222-1227. [谢木娇, 区又君, 温久福, 等. 四指马鲅消化道黏液细胞的发育规律[J]. 南方农业学报, 2016, 47(7): 1222-1227.] |
| [23] |
Xie M J, Ou Y J, Weng J F, et al. Observation on embryonic development of Eleutheronema tetradactylum[J]. Journal of Applied Oceanography, 2016, 35(3): 405-411. [谢木娇, 区又君, 温久福, 等. 四指马鲅胚胎发育观察[J]. 应用海洋学学报, 2016, 35(3): 405-411.] |
| [24] |
Shihab I, Gopalakrishnan A, Vineesh N, et al. Histological profiling of gonads depicting protandrous hermaphroditism in Eleutheronema tetradactylum[J]. Journal of Fish Biology, 2017, 90(6): 2402-2411. DOI:10.1111/jfb.13324 |
| [25] |
Wen R S, Zeng D L, Fang Z Q. Histological Studies on the Oogenesis of Xiphophorus helleri[J]. Chinese Journal of Zoology, 2012, 47(6): 85-91. [温茹淑, 曾德莉, 方展强. 剑尾鱼卵子发生的组织学观察[J]. 动物学杂志, 2012, 47(6): 85-91.] |
| [26] |
Wang Z J, Luo H, Zhang Y G, et al. Histological studies of the oogenesis of Gambusia affinis[J]. Journal of Chongqing Normal University: Natural Science, 2008, 25(3): 8-12. [王志坚, 罗虹, 张耀光. 食蚊鱼卵子发生的组织学观察[J]. 重庆师范大学学报:自然科学版, 2008, 25(3): 8-12.] |
| [27] |
Lin D J, You Y L. The ovarian cyclical development of ovoviviparous teleost, Sebastiscus marmoratus[J]. Zoological Research, 2000, 21(4): 269-274. [林丹军, 尤永隆. 卵胎生硬骨鱼褐菖鲉卵巢的周期发育研究[J]. 动物学研究, 2000, 21(4): 269-274.] |
| [28] |
Yin H B, Jia Z H, Yao D X, et al. Sex differentiation in Pelteobagrus fulvidraco[J]. Chinese Journal of Zoology, 2008, 43(6): 103-108. [尹洪滨, 贾中贺, 姚道霞, 等. 黄颡鱼性腺分化的组织学观察[J]. 动物学杂志, 2008, 43(6): 103-108.] |
| [29] |
Wang M L, Chen J J, Shi H L, et al. Study on the gonadal development and individual fecundity of Trachindercnus fasciatus heckle in dalian sea area coast[J]. Journal of Yangtze University: Natural Science Edition, 2018, 15(22): 35-38. [王茂林, 陈家捷, 史会来, 等. 大连海域松江鲈鱼亲鱼性腺发育及繁殖力研究[J]. 长江大学学报:自然科学版, 2018, 15(22): 35-38.] |
| [30] |
Lin D, Lin H R. Studies on the breeding biology of the eel (Anguilla japonica Temminck & Schlegel 3. Histological and cytological studies on the gonadal development of eel)[J]. Acta Hydrobiologica Sinica, 1984, 8(2): 157-170. [林鼎, 林浩然. 鳗鲡繁殖生物学研究Ⅲ.鳗鲡性腺发育组织学和细胞学研究[J]. 水生生物学集刊, 1984, 8(2): 157-170.] |
| [31] |
Li P L, Liu W, Wang J L, et al. The histological studies on the oogenesis and the morphological structure of the mature egg envelope in Siberian Gudgeon Gobio cynocephalus[J]. Chinese Journal of Zoology, 2014, 49(5): 707-715. [李培伦, 刘伟, 王继隆. 犬首鮈卵子发生过程及成熟卵膜形态结构观察[J]. 动物学杂志, 2014, 49(5): 707-715.] |
| [32] |
Cui D, Liu Z W, Liu N X, et al. Histological study on the gonadal development of Scatophagus argus[J]. Journal of Fisheries of China, 2013, 37(5): 696-704. [崔丹, 刘志伟, 刘南希, 等. 金钱鱼性腺发育及其组织结构观察[J]. 水产学报, 2013, 37(5): 696-704.] |
| [33] |
Zhang X F, Zhang Y G, Gan G M, et al. Preliminary studies on ovary development and oogenesis in Coreius guichenoti[J]. Journal of Southwest Agricultural University: Natural Science, 2005, 27(6): 892-897. [张贤芳, 张耀光, 甘光明, 等. 圆口铜鱼卵巢发育及卵子发生的初步研究[J]. 西南农业大学学报:自然科学版, 2005, 27(6): 892-897.] |
| [34] |
Xu Y J, Liu X Z, Liu J G, et al. Histological and morphometric studies on the annual gonadal maturation cycle of spotted halibut Verasper variegatus[J]. Progress in Fishery Sciences, 2011, 32(3): 7-15. [徐永江, 柳学周, 刘君刚, 等. 圆斑星鲽卵巢发育的组织学和数量形态特征研究[J]. 渔业科学进展, 2011, 32(3): 7-15.] |
| [35] |
Liu X Z, Xu Y J, Liu N Z, et al. Study on histological and morphometric characters of gonad development of Cynoglossus semilaevis Giinther[J]. Progress in Fishery Sciences, 2009, 30(6): 25-35. [柳学周, 徐永江, 刘乃真, 等. 半滑舌鳎卵巢发育的组织学和形态数量特征研究[J]. 渔业科学进展, 2009, 30(6): 25-35.] |
| [36] |
Merson R. Oocyte development in summer flounder: seasonal changes and steroid correlates[J]. Journal of Fish Biology, 2000, 57(1): 182-196. DOI:10.1111/j.1095-8649.2000.tb00785.x |
| [37] |
Shi Q F. Recent advance in the studies on gonadal development in fishes[J]. Acta Hydrobiologica Sinica, 1988, 12(3): 248-258. [施瑔芳. 鱼类性腺发育研究新进展[J]. 水生生物学报, 1988, 12(3): 248-258.] |
 2020, Vol. 27
2020, Vol. 27

