2. 中国水产科学研究院黄海水产研究所, 山东 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室, 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071;
4. 威海市渔业技术推广站, 山东 威海 264200
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology, Qingdao 266071, China;
4. Weihai Fishery Technology Extension Station, Weihai 264200, China
长蛸(Octopus minor)属于八腕目(Octopoda), 蛸科(Octopodidae), 蛸属, 分布于渤海、黄海、东海、南海和日本列岛水域, 肉质鲜嫩, 蛋白质丰富且营养均衡[1], 是中国沿海重要的经济蛸类[2]。在运输过程中, 长蛸在狭小空间里会强烈挣扎, 导致体表破损、自残(断腕)和喷墨, 死亡率较高。在实验操作中长蛸剧烈挣扎甚至喷墨, 导致实验无法顺利进行。同时, 欧盟要求在科学研究过程中需要考虑头足类的动物福利, 规定所有适用于脊椎动物的手术和实验操作也同样适用于头足类, 尽量减少疼痛和持久伤害[3-5]。根据这一规定, 头足类的实验操作应在麻醉和镇痛下进行, 当必须杀死实验样本时, 需要尽可能降低死亡过程的痛苦程度。因此, 筛选头足类适宜的麻醉剂, 并探明相应的麻醉复苏过程对于头足类的产业发展和科学研究具有重要意义。
在已有头足类麻醉剂研究中, 7.5%六水氯化镁溶液能够有效麻醉乌贼(Sepia officinalis)、福氏枪乌贼(Loligo forbesii)、锥异尾枪乌贼(Alloteuthis subulata)、真蛸(Octopus vulgaris)和尖盘爱尔斗蛸(Eledone cirrhosa)[6]。乙二醇苯醚麻醉爱尔斗蛸(Eledone moschata)的有效浓度为1.2 mL/L、1.4 mL/L和1.6 mL/L[7]。1%~3%乙醇作为乌贼手术时的麻醉剂[8], 1.5%乙醇可以有效麻醉真蛸[9]。在使用氯化镁、苯佐卡因、乙醇和丁香油麻醉皮氏枪乌贼(Doryteuthis pealeii)时, 乙醇和氯化镁具有麻醉作用[10]。丁香油浓度为200 mg/L时适宜作为长蛸的麻醉剂[11]。使用乙二醇苯醚、MS-222、氯化镁、乙醇和丁香油麻醉乌贼时, 氯化镁、乙醇和丁香油能够麻醉乌贼, 氯化镁溶液麻醉乌贼的适宜浓度为27 g/L[12]。使用乙醇、氯化镁、硫酸镁、氯仿和水合氯醛麻醉拟乌贼(Sepiotethis sepioidea)时, 1%~3%乙醇、1.5%~2%氯化镁和3%~4%硫酸镁具有麻醉效果[13]。氨基甲酸乙酯曾在真蛸和乌贼中用作麻醉剂[14-15], 但由于氨基甲酸乙酯属于致癌物质, 不再使用其作为麻醉剂[4, 16-17]。目前在头足类麻醉和复苏过程中对行为的描述[12, 18-19]相对较少, 且关于长蛸麻醉的研究较少。
综上所述, 本研究在参考前人研究工作的基础上, 挑选12种具有潜在麻醉作用的化学试剂对长蛸进行麻醉实验, 旨在筛选出适宜的长蛸麻醉试剂, 掌握长蛸麻醉和复苏的方法, 为实验操作和生产运输提供参考依据。
1 材料与方法 1.1 实验样本长蛸来自于威海裕隆水产开发有限公司, 体质量范围为138~151 g。
1.2 实验海水经过砂滤的天然海水, 盐度为28~30, 水温为(18±0.3) ℃, pH为8.0~8.2, DO > 6 mg/L。
1.3 麻醉剂与麻醉方法实验的麻醉剂有氯化锰、硫酸镁、乙二醇苯醚、乙醇、薄荷醇、利多卡因、氯化镁、MS-222、丁香酚、三氯叔丁醇、盐酸普鲁卡因和苯佐卡因。由于将长蛸放入带有麻醉剂的水体中及实验捞取、转移等操作, 会引起应激反应, 导致长蛸出现剧烈挣扎、四处游动、向水体外爬、喷墨等现象, 干扰实验准确性, 本研究采用向带有长蛸的水体中加入麻醉剂的方法开展实验。
1.4 实验器材分析天平、塑料箱(47 cm×34 cm×32 cm)、电子温度计、1000 mL烧杯、增氧泵、电子秤。
1.5 麻醉剂的配制无水氯化镁易溶于水, 溶解过程中放出大量热, 用海水配制质量浓度为320 g/L的氯化镁溶液作为母液。MS-222、乙醇、氯化锰、盐酸普鲁卡因、硫酸镁和乙二醇苯醚易溶于水, 称取药品于烧杯中, 用海水溶解后按比例加入实验水体。丁香酚、利多卡因、苯佐卡因、三氯叔丁醇和薄荷醇微溶于水, 丁香酚使用时以1:5的比例溶于无水乙醇; 利多卡因和苯佐卡因使用时以1:4的比例溶于无水乙醇; 三氯叔丁醇10 g和薄荷醇晶体0.5 g分别溶解于100 mL无水乙醇中配制成母液。每种麻醉剂用于麻醉效果测定的浓度水平如表 1所示。
|
|
表 1 麻醉剂用于麻醉效果测定的浓度水平 Tab.1 Levels of anesthetic concentration for the anesthesia effect test |
实验前选择体表无损伤、有活力的健康长蛸, 停食24 h。每个浓度实验设置3个平行组, 每组长蛸3只, 实验水体20 L。塑料箱中加正常海水, 放入长蛸稳定10 min, 观察长蛸的活动状态。对长蛸活动稳定的组进行实验, 将配置好的麻醉剂按比例加入实验水体, 发现长蛸完全麻醉后, 立即将其转移到正常海水中进行复苏。记录在此过程中出现的各种行为特征及时间点。
1.7 麻醉与复苏分期测定根据麻醉效果实验结果, 设计4 mL/L、6 mL/L、8 mL/L、10 mL/L、15 mL/L、25 mL/L、35 mL/L、40 mL/L 8个乙醇浓度梯度和4 g/L、6 g/L、8 g/L、10 g/L、15 g/L、25 g/L、30 g/L、40 g/L 8个氯化镁溶液梯度, 每个浓度长蛸1只, 平行重复3次以上, 进行观察记录。
1.8 最终麻醉程度测定依据麻醉分期结果, 设计4 mL/L、6 mL/L、8 mL/L、10 mL/L、15 mL/L、20 mL/L、25 mL/L、35 mL/L、40 mL/L 9个乙醇浓度梯度和3 g/L、5 g/L、8 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L、35 g/L 9个氯化镁溶液梯度, 每个浓度长蛸1只, 平行重复3次以上, 测定24 h内长蛸达到的最终麻醉程度。
1.9 麻醉及复苏时间测定根据麻醉与复苏分期结果, 设计4 mL/L、6 mL/L、8 mL/L、10 mL/L、25 mL/L、35 mL/L、40 mL/L 7个乙醇浓度梯度和3 g/L、5 g/L、8 g/L、10 g/L、20 g/L、30 g/L、35 g/L 7个氯化镁溶液梯度, 每个浓度长蛸1只, 平行重复3次以上, 分别测定长蛸达到最终麻醉和转入正常海水到复苏的时间。
2 结果与分析 2.1 麻醉剂对长蛸的麻醉效果实验结果(表 2)表明, 硫酸镁、丁香酚、MS-222、氯化锰、利多卡因、盐酸普鲁卡因、乙二醇苯醚、薄荷醇、苯佐卡因和三氯叔丁醇溶液在实验浓度下对长蛸无麻醉作用, 稍高浓度中长蛸出现高盐胁迫反应或中毒现象。长蛸在6~40 mL/L浓度乙醇和6~35 g/L浓度氯化镁溶液中出现麻醉现象。
|
|
表 2 12种麻醉剂对长蛸麻醉效果 Tab.2 The anesthesia effect of 12 anesthetics on Octopus minor |
根据长蛸的体表颜色变化, 根据游泳活力强弱、呼吸频率变化、腕部活动能力强弱、吸盘吸力强弱、腕部对玻璃棒刺激的反应和将头部翻转眼睛向下是否能够恢复正常这6个指标, 将其区分为5个麻醉时期(表 3)和4个复苏时期(表 4)。
|
|
表 3 长蛸麻醉程度分期及行为特征 Tab.3 Stages and behavior characteristics of Octopus minor under anesthesia |
|
|
表 4 长蛸复苏分期及行为特征 Tab.4 Recovery stages and behavior characteristics of Octopus minor |
随着乙醇和氯化镁浓度的增加, 长蛸达到的最终麻醉程度增大(图 1, 图 2)。10~40 mL/L乙醇溶液和15~35 g/L氯化镁溶液对长蛸麻醉均能够达到第4期麻醉, 此时期能够有效麻醉长蛸, 进行观察和测量等操作而不伤害长蛸。长蛸在40 mL/L乙醇和35 g/L氯化镁中达到5期麻醉, 表现为呼吸停止, 应及时转移进行复苏否则死亡, 表明过高浓度乙醇和氯化镁导致长蛸死亡。
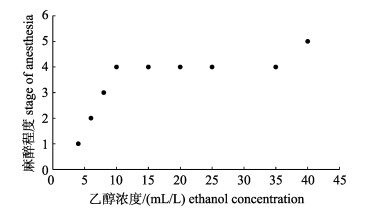
|
图 1 长蛸在9种乙醇浓度中达到的最终麻醉程度 Fig.1 Final anesthetic stages of Octopus minor under nine ethanol concentrations |
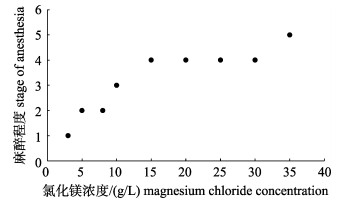
|
图 2 长蛸在9种氯化镁浓度中达到的最终麻醉程度 Fig.2 Final anesthetic stages of Octopus minor under nine magnesium chloride concentrations |
图 3表明, 以4~35 mL/L浓度的乙醇作为长蛸麻醉剂, 随着浓度增加, 麻醉时间从128 min到8 min逐渐缩短, 复苏时间从5 min到26 min逐渐增加。在40 mL/L乙醇中出现剧烈挣扎, 麻醉时间明显增加, 可见乙醇浓度过高容易导致长蛸产生应激反应。图 4表明, 以3~35 g/L的氯化镁溶液作为长蛸麻醉剂, 随着浓度增加, 麻醉时间从176 min到13 min逐渐缩短, 复苏时间从6 min到116 min逐渐增加。
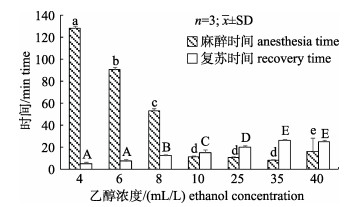
|
图 3 长蛸在7个乙醇浓度梯度下的麻醉与复苏时间 不同小写字母表示不同乙醇浓度下麻醉时间差异显著(P < 0.05), 不同大写字母表示不同乙醇浓度下复苏时间差异显著(P < 0.05). Fig.3 Anesthesia time and recovery time of Octopus minor under 7 ethanol concentrations Different small letters indicate significant differences on anesthesia time (P < 0.05) and capital letter indicate significant differences on recovery time (P < 0.05). |
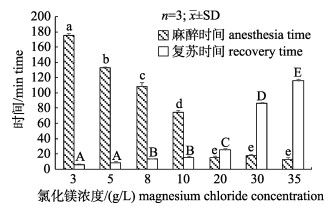
|
图 4 长蛸在7个氯化镁浓度梯度下的麻醉和复苏时间 不同小写字母表示不同乙醇浓度下麻醉时间差异显著(P < 0.05), 不同大写字母表示不同乙醇浓度下复苏时间差异显著(P < 0.05). Fig.4 Anesthesia time and recovery time of Octopus minor under 7 magnesium chloride concentrations Different small letters indicate significant differences on anesthesia time (P < 0.05) and capital letter indicate significant differences on recovery time (P < 0.05). |
本研究中, 麻醉效果的判定基于长蛸的体色、活动量、呼吸频率和对外界刺激反应变化, 以及麻醉过程中是否产生高盐胁迫或中毒现象。基于上述标准, 发现乙醇和氯化镁对长蛸有麻醉作用, 综合比较长蛸在不同浓度作用下的最终麻醉状态、麻醉及复苏时间, 得出乙醇和氯化镁麻醉的有效浓度为10~40 mL/L和15~35 g/L。已有研究表明, 乙醇和氯化镁能够有效麻醉真蛸[20]、皮氏枪乌贼[10]、乌贼[12]和拟乌贼[13]。本研究中乙醇和氯化镁能够有效麻醉长蛸, 说明乙醇和氯化镁可作为头足类潜在的通用麻醉剂, 其余10种麻醉剂对其他头足类具有麻醉作用, 因物种、生活方式与实验方法的不同, 有待进一步进行探究。
本研究表明, 10 mL/L的乙醇对长蛸产生快速的麻醉作用, 没有明显的痛苦迹象。结果与乙醇麻醉乌贼、真蛸、皮氏枪乌贼和拟乌贼效果相似, 使用乙醇做麻醉剂无不良反应[9-10, 13, 19, 21]。实验通过麻醉与复苏最短总时间对乙醇和氯化镁的麻醉效果进行比较, 乙醇的最短总时间为26 min (浓度10 mL/L), 氯化镁为40 min (20 g/L), 在麻醉和复苏的效率上, 乙醇好于氯化镁。根据上述结果, 当长蛸的麻醉操作时间短于15 min时, 使用乙醇作为麻醉剂, 而MgCl2溶液更适合超过15 min的麻醉操作。图 3和图 4结果表明, 在一定浓度范围内, 随着麻醉剂浓度的增加, 长蛸麻醉所需时间不断缩短, 同时复苏时间不断增加, 这与圆斑星鲽(Verasper variegates)[22]、许氏平鲉(Sebastes schlegeli)[23]、日本对虾(Penaeus japonicus)[24]和大口黑鲈(Micropterus salmoides)[25]等的研究结果一致。
丁香油作为一种麻醉化合物在长乌贼(Sepia elongata)、皮氏枪乌贼和长蛸中已经得到了应用, 麻醉后死亡率极低, 麻醉和复苏时间短[10-11, 26]。然而, 部分学者在丁香油中添加乙醇以促进其在海水中的溶解[11, 26], 由于乙醇对长蛸具有麻醉作用, 乙醇的添加干扰了对丁香油是否具有麻醉作用的判定。Mooney等[10]在使用不添加乙醇的丁香油麻醉皮氏枪乌贼时, 出现了喷墨、体色剧烈变化和死亡的现象。Estefanell等[9]和Escánez等[20]在使用丁香油麻醉真蛸时, 真蛸未麻醉并出现喷墨等应激反应。本研究中, 长蛸在低浓度丁香酚中无麻醉作用, 在稍高浓度丁香酚中出现全身僵直和喷墨现象, 结论为丁香酚不能作为长蛸的麻醉剂。
3.2 麻醉与复苏过程Butler-Struben等[18]和Winlow等[27]总结了在头足类麻醉研究中常用的麻醉状态判定参考依据, 包括呼吸频率变化、体色变化和对按压刺激有无反应。Andrews等[4]对头足类麻醉状态判定标准进行了探讨, 包括呼吸频率、体色变淡、腕部活动、吸盘吸力、身体平衡的失去与恢复和对有害刺激的反应。本研究在参考前人工作的基础上, 选择长蛸的体色变化、游泳活力强弱、呼吸频率高低变化、腕部活力大小、吸盘吸力强弱、腕部对玻璃棒刺激的反应和将头部翻转眼睛向下的反应作为长蛸麻醉和复苏程度的判定标准。
长蛸麻醉初期四处爬行和游动, 随后吸附于容器的一处, 腕部活动频繁。用玻璃棒刺激腕部, 腕部反应迅速, 将长蛸头部翻转眼部向下能够迅速恢复至原状态。随着麻醉时间延长, 体色由浅棕色逐渐变白, 呼吸频率逐渐降低, 腕部活动频率由有到无, 腕部对玻璃棒刺激的反应逐渐迟钝直至无反应, 吸盘吸力不断减弱直至无吸力, 长蛸头部翻转眼部向下的反应从迅速恢复到挣扎后恢复到最后不能恢复。复苏时, 外套膜的收缩舒张幅度由大变小, 呼吸频率逐渐变快后稳定, 腕部开始活动并支撑身体平衡, 体色逐渐恢复为浅棕色。
3.3 最终麻醉状态长蛸的最终麻醉状态是确定运输过程适宜麻醉剂量的重要参考标准。在鱼类麻醉研究中, 视觉与触觉丧失, 呼吸频率略减, 并且能够维持自身平衡是适宜运输的最佳状态[28]。长蛸达到第2期麻醉时, 腕部对外界刺激反应迟缓, 呼吸频率降低, 能够保持身体平衡, 可作为运输的最适麻醉阶段。若麻醉程度达到第4、5期, 长蛸将失去平衡, 沉到容器底部, 易造成个体间的挤压, 增加死亡率。本研究初步测得24 h内长蛸达到的最终麻醉时期:在乙醇浓度为6 mL/L和氯化镁浓度为5 g/L、8 g/L时为2期, 乙醇浓度为8 mL/L和氯化镁浓度为10 g/L时为3期, 可以作为长蛸运输过程中麻醉剂使用的参考标准。
3.4 展望头足类的年龄、性别、生长阶段、体重、生理与健康状况之间的差异对麻醉剂有效性的影响, 以及麻醉剂与环境参数之间的相互作用, 仍有待探索。乙醇产生镇静效果似乎与水温有关:在较低温度下乙醇麻醉枪乌贼(Loligo pealii)的效果会下降[29], 在19~26 ℃下麻醉乌贼、皮氏枪乌贼、福氏枪乌贼和真蛸的效果稳定[19]。在整个麻醉过程中, 需要控制溶液的盐度变化, 因为添加MgCl2会引起盐度改变, 盐度改变可能影响头足类的生理与健康状态, 从而影响麻醉效果。目前头足类已筛选出多种药物或试剂作为麻醉剂(如氯化镁和乙醇), 麻醉剂对头足类的生理影响[18, 30-31]和麻醉作用的机制有待进一步探究。
| [1] |
Qian Y S, Zheng X D, Wang P L, et al. Analysis and evaluation of nutritive composition of Octopus minor in Lake Swan[J]. Marine Sciences, 2010, 34(12): 14-18. [钱耀森, 郑小东, 王培亮, 等. 天鹅湖长蛸营养成分的分析及评价[J]. 海洋科学, 2010, 34(12): 14-18.] |
| [2] |
Xue J, Ma J M, Zhang X X, et al. Analysis and quality evaluation of nutritional components in the muscle of two kinds of octopus[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(12): 203-211. [薛静, 马继民, 张信祥, 等. 两种海洋蛸类营养成分分析与评价[J]. 中国食品学报, 2015, 15(12): 203-211.] |
| [3] |
Smith J A, Andrews P L R, Hawkins P, et al. Cephalopod research and EU Directive 2010/63/EU:Requirements, impacts and ethical review[J]. Journal of Experimental Marine Biology and Ecology, 2013, 447: 31-45. DOI:10.1016/j.jembe.2013.02.009 |
| [4] |
Andrews P L R, Darmaillacq A S, Dennison N, et al. The identification and management of pain, suffering and distress in cephalopods, including anaesthesia, analgesia and humane killing[J]. Journal of Experimental Marine Biology and Ecology, 2013, 447: 46-64. DOI:10.1016/j.jembe.2013.02.010 |
| [5] |
Cristina G D, Andrews P, Ponte G, et al. The impact of Directive 2010/63/EU on cephalopod research[J]. Invertebrate Neuroscience, 2015, 15(4): 1-7. |
| [6] |
Messenger J B, Nixon M, Ryan K P. Magnesium chloride as an anaesthetic for cephalopods[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology, 1985, 82(1): 203-205. |
| [7] |
Şen H, Tanrikul T T. Efficacy of 2-phenoxyethanol as an anaesthetic for the musky octopus, Eledone moschata (Lamarck 1799), (Cephalopoda:Octopodidae)[J]. Turkish Journal of Veterinary and Animal Sciences, 2009, 33(6): 463-467. |
| [8] |
Harms C A, Lewbart G A, McAlarney R, et al. Surgical excision of mycotic (Cladosporium sp.) granulomas from the mantle of a cuttlefish (Sepia officinalis)[J]. Journal of Zoo and Wildlife Medicine, 2006, 37(4): 524-530. DOI:10.1638/06-033.1 |
| [9] |
Estefanell J, Socorro J, Afonso J M, et al. Evaluation of two anesthetic agents and the passive integrated transponder tagging system in Octopus vulgaris (Cuvier 1797)[J]. Aquaculture Research, 2011, 42(3): 399-406. DOI:10.1111/j.1365-2109.2010.02634.x |
| [10] |
Mooney T A, Lee W J, Hanlon R T. Long-duration anesthetization of squid (Doryteuthis pealeii)[J]. Marine and Freshwater Behaviour and Physiology, 2010, 43(4): 297-303. DOI:10.1080/10236244.2010.504334 |
| [11] |
Seol D W, Lee J, Im S Y, et al. Clove oil as an anaesthetic for common octopus (Octopus minor, Sasaki)[J]. Aquaculture Research, 2007, 38(1): 45-49. |
| [12] |
Gonçalves R A, Aragão C, Frias P A, et al. The use of different anaesthetics as welfare promoters during short-term human manipulation of European cuttlefish (Sepia officinalis) juveniles[J]. Aquaculture, 2012, 370-371: 130-135. DOI:10.1016/j.aquaculture.2012.10.014 |
| [13] |
García-Franco M. Anaesthetics for the squid Sepioteuthis sepioidea (Mollusca:Cephalopoda)[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology, 1992, 103(1): 121-123. DOI:10.1016/0742-8413(92)90239-4 |
| [14] |
Andrews P L R, Tansey E M. The effects of some anaesthetic agents in Octopus vulgaris[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology, 1981, 70(2): 241-247. DOI:10.1016/0306-4492(81)90057-5 |
| [15] |
Messenger J B. The visual attack of the cuttlefish, Sepia officinalis[J]. Animal Behaviour, 1968, 16(2): 342-357. |
| [16] |
Fiorito G, Affuso A, Basil J, et al. Guidelines for the care and welfare of cephalopods in research -A consensus based on an initiative by CephRes, FELASA and the Boyd Group[J]. Laboratory Animals, 2015, 49(S2): 1-90. |
| [17] |
Newth D R. The anatomy of the nervous system of Octopus vulgaris[J]. Journal of Neurology, Neurosurgery & Psychiatry, 1972, 35(3): 65-102. |
| [18] |
Butler-Struben H M, Brophy S M, Johnson N A, et al. In vivo recording of neural and behavioral correlates of anesthesia induction, reversal, and euthanasia in cephalopod molluscs[J]. Frontiers in Physiology, 2018, 9: 109. DOI:10.3389/fphys.2018.00109 |
| [19] |
Gleadall I G. The effects of prospective anaesthetic substances on cephalopods:Summary of original data and a brief review of studies over the last two decades[J]. Journal of Experimental Marine Biology and Ecology, 2013, 447: 23-30. DOI:10.1016/j.jembe.2013.02.008 |
| [20] |
Escánez A, Rubio J, Riera R, et al. Assessment of various anesthetic agents on Octopus vulgaris paralarvae[J]. Journal of the World Aquaculture Society, 2018, 49(6): 1019-1025. DOI:10.1111/jwas.12444 |
| [21] |
Shomrat T, Graindorge N, Bellanger C, et al. Alternative sites of synaptic plasticity in two homologous "fan-out fan-in" learning and memory networks[J]. Current Biology, 2011, 21(21): 1773-1782. DOI:10.1016/j.cub.2011.09.011 |
| [22] |
Zhao M, Liu X Z, Xu Y J, et al. Study on anaesthetic effects of MS-222 on adult Verasper variegates[J]. Advances in Marine Science, 2010, 28(4): 531-537. [赵明, 柳学周, 徐永江, 等. MS-222麻醉圆斑星鲽成鱼效果研究[J]. 海洋科学进展, 2010, 28(4): 531-537. DOI:10.3969/j.issn.1671-6647.2010.04.014] |
| [23] |
Guan J, Guan S G, Zheng Y Y, et al. Effects of 2-phenoxyethanol and clove oil as anaesthetics on juvenile Sebastes schlegeli[J]. Progress in Fishery Sciences, 2010, 31(6): 22-28. [关健, 官曙光, 郑永允, 等. 2-苯氧乙醇和丁香酚对许氏平鲉幼鱼麻醉效果的实验研究[J]. 渔业科学进展, 2010, 31(6): 22-28. DOI:10.3969/j.issn.1000-7075.2010.06.004] |
| [24] |
Ping H L, Shi H L, Yu F P, et al. The anaesthesia effects of MS-222 for Penaeus japonicus[J]. Journal of Aquaculture, 2018, 39(4): 1-4, 8. [平洪领, 史会来, 余方平, 等. MS-222对日本对虾麻醉效果的研究[J]. 水产养殖, 2018, 39(4): 1-4, 8. DOI:10.3969/j.issn.1004-2091.2018.04.001] |
| [25] |
Wang W H, Dong H B, Sun Y X, et al. Anesthetic effects of MS-222 and eugenol in simulated transportation of juvenile largemouth bass (Micropterus salmoides)[J]. South China Fisheries Science, 2018, 14(6): 52-58. [王文豪, 董宏标, 孙永旭, 等. MS-222和丁香酚在大口黑鲈幼鱼模拟运输中的麻醉效果[J]. 南方水产科学, 2018, 14(6): 52-58.] |
| [26] |
Darmaillacq A S, Shashar N. Lack of polarization optomotor response in the cuttlefish Sepia elongata (d'Orbigny, 1845)[J]. Physiology & Behavior, 2008, 94(4): 616-620. |
| [27] |
Winlow W, Polese G, Moghadam H F, et al. Sense and insensibility-an appraisal of the effects of clinical anesthetics on gastropod and cephalopod molluscs as a step to improved welfare of cephalopods[J]. Frontiers in Physiology, 2018, 9: 1147. DOI:10.3389/fphys.2018.01147 |
| [28] |
Cooke S J, Suski C D, Ostrand K G, et al. Behavioral and physiological assessment of low concentrations of clove oil anaesthetic for handling and transporting largemouth bass (Micropterus salmoides)[J]. Aquaculture, 2004, 239(1-4): 509-529. DOI:10.1016/j.aquaculture.2004.06.028 |
| [29] |
Moore J W. Effect of ethanol on the sodium and potassium conductances of the squid axon membrane[J]. The Journal of General Physiology, 1964, 48(2): 279-295. DOI:10.1085/jgp.48.2.279 |
| [30] |
Pugliese C, Mazza R, Andrews P L R, et al. Effect of different formulations of magnesium chloride used as anesthetic agents on the performance of the isolated heart of Octopus vulgaris[J]. Frontiers in Physiology, 2016, 7: 610. |
| [31] |
O'Brien C E, Roumbedakis K, Winkelmann I E. The current state of cephalopod science and perspectives on the most critical challenges ahead from three early-career researchers[J]. Frontiers in Physiology, 2018, 9: 700. DOI:10.3389/fphys.2018.00700 |
 2020, Vol. 27
2020, Vol. 27

