2. 福建省海洋生物增养殖与高值化利用重点实验室, 福建 厦门 361013
2. Key Laboratory of Cultivation and High-Value Utilization of Marine Organisms in Fujian Province, Xiamen 361013, China
红条鞭腕虾(Lysmata vittata)隶属于节肢动物门(Arthropoda), 软甲纲(Malacostraca), 真虾总目(Eucarida), 十足目(Decapoda), 藻虾科(Hippolytidae), 鞭腕虾属[1]。它是清洁虾家族中的一员, 为常见的海洋观赏生物种类, 分布于东非、埃及地中海沿岸、菲律宾、日本、澳大利亚、新西兰、中国黄海和俄罗斯东部的印度–太平洋海域, 因其身上具有鲜红色纵纹且以有机碎屑、藻类及玻璃海葵为主食的习性, 常常被当成观赏性清洁虾饲养于水族箱中[2]。目前, 红条鞭腕虾的人工繁育技术仍未达到工厂化育苗水平, 无法满足观赏水族市场的需求。因此, 水族箱中饲养的红条鞭腕虾主要来源于海区自然捕捞, 存在品种供应不稳定、运输贩售环节损失大、虾的品质没有保证等问题。
营养因子和环境因子, 包括饵料、水温、光照、盐度、pH、营养盐、重金属等方面, 对鞭腕虾属虾类的繁殖行为有重要的影响[3-6]。红条鞭腕虾同时具有卵巢和精巢, 但不能自体交配, 为雌雄同体, 异体受精[7]。刚出生的红条鞭腕虾的幼体为溞状幼体, 营浮游生活。虽然有部分学者和观赏虾爱好者开展了红条鞭腕虾的人工育苗工作, 但关于其繁殖生物学的研究报道尚少。本研究通过调节光照强度来研究不同光照下红条鞭腕虾亲虾的抱卵情况, 并通过投喂不同生物饵料来比较虾苗幼体的生长发育周期和成活率, 同时跟踪观察幼体形态发育全过程, 详细描述溞状幼体发育过程中的形态和结构变化, 以期为进一步开展红条鞭腕虾以及其他鞭腕虾属虾类的人工繁育研究提供理论基础。
1 材料与方法 1.1 实验用虾实验亲虾购自山东观赏鱼市场, 共96尾, 体长4.2~5.0 cm, 体重2.5~3.0 g, 均为中国黄海海区捕获。
1.2 养殖用水实验养殖用水采用二级过滤的沙滤天然海水, 通过漂白粉消毒, 充分曝气去除余氯以及水草净化后使用。
1.3 亲虾养殖实验及饲养管理将亲虾按照相近的体长、体重均匀放置于6个水族箱中, 每个水族箱中有16尾虾, 水族箱共用一个循环水系统。水族箱规格为30 cm×40 cm× 50 cm, 每个水箱均放入羽毛藻供亲虾躲避栖息。饲养期间水温维持在(25.0±0.5) ℃, 盐度为30.0± 1.0, pH为8.0±0.5, NH3-N水平低于0.5 mg/L, NO2-N水平低于0.1 mg/L, 溶解氧含量高于5 mg/L。根据光照强度差异, 实验分为2组, 分别为正常光照组和全暗(黑)组, 每组3个重复(每个重复16尾亲虾)。正常光照组在水族箱上方分别配置两根25 W日光灯管作为光源进行照明, 平均光照强度为1000 lx, 并使用定时器控制开关灯时间, 模拟自然光每天照射12 h (上午6:00至下午18:00)。全暗(黑)组使用黑色塑料薄膜将每组亲虾与自然光隔离, 确保没有光照进入水族箱中, 并进行24 h遮光处理。循环水系统每两周换水50%, 实验亲虾每天投喂3次(8:00, 12:00和18:00)自行配制的饲料(虾肉、鱼肉、牡蛎、鳗鱼粉、鱿鱼和螺旋藻粉按一定比例混合), 每天投喂完半小时后及时吸污和补水。实验周期为1个月, 实验期间观察统计各组亲虾的抱卵情况。
1.4 虾苗收集根据亲虾的抱卵情况, 将即将孵出幼苗的亲虾转移到专门的幼苗收集容器中, 每个幼苗收集容器中只放1尾亲虾, 便于幼苗计数。待幼苗产出后, 立即把亲虾转移到亲虾养殖水族箱中。
1.5 虾苗投喂实验及饲养管理随机挑选亲虾同天产出的2400尾虾苗幼体, 将其均匀放置于8个虾苗幼体养殖箱中, 每箱300尾。根据投喂饵料的差异, 实验分为两组:投喂丰年虫组(单一组)以及投喂丰年虫和裸腹溞组(混合组), 每组4个重复(其中3个重复用于虾苗幼体存活率统计, 1个重复用于虾苗幼体形态结构观察, 每个重复300尾幼体)。在整个实验过程中, 投喂丰年虫组的虾苗只单独投喂丰年虫无节幼体, 丰年虫无节幼体由购买于厦门市壹大海洋科技有限公司的丰年虫卵孵化所得。投喂丰年虫和裸腹溞混合组的虾苗从孵化出来开始连续投喂3 d的丰年虫无节幼体, 之后只投喂实验室培养的蒙古裸腹溞。为保证虾苗饵料充足, 投喂丰年虫或蒙古裸腹溞的饵料密度为2~3个/mL, 每天上午、中午和晚上观察3次, 发现饵料不足及时补充。虾苗养殖光照条件和水质条件与亲虾正常光照组保持一致。
1.6 虾苗幼体形态和结构观察整个虾苗幼体发育期每天固定各实验组5尾虾苗, 用徕卡解剖镜和显微镜观察幼虾发育的形态结构, 测量体长并拍照, 直至虾苗完全变态为仔虾。记录幼体的变态次数、生长发育周期以及成活率。
1.7 统计分析实验数据采用SPSS18.0软件进行统计分析, 通过独立样本T检验比较组间的数据差异。数据结果以平均值±标准差(x±SD)表示, 当P < 0.05时表示差异显著[8]。
2 结果与分析 2.1 不同光照强度对红条鞭腕虾亲虾抱卵的影响正常光照组中红条鞭腕虾亲虾的抱卵率为(95.8±3.6)%, 而全暗(黑)组亲虾均不抱卵, 表明光照强弱对红条鞭腕虾亲虾抱卵率有显著影响(P < 0.05, 图 1, 表 1)。在25 ℃水温条件下, 红条鞭腕虾的整个胚胎发育过程需12~16 d, 颜色先从翠绿色变成淡黄色, 再变为明显的咖啡色, 并在虾卵胚胎发育的后期用肉眼可以清晰地观察到眼点(图 1)。

|
图 1 红条鞭腕虾胚胎发育情况观察 a.未抱卵亲虾的背部图; b.排卵1 d后亲虾的背部图; c.排卵10 d后亲虾的背部图; d.未抱卵亲虾的腹部图; e.排卵1 d后亲虾的腹部图, 示虾卵; f.排卵10 d后亲虾的腹部图, 示眼点. Es:眼点; Fo:受精卵. Fig.1 The embryo development of Lysmata vittata a. The dorsal view of parent shrimp without eggs; b. The dorsal view of parent shrimp after 1 d of ovulation; c. The dorsal view of parent shrimp after 10 d of ovulation; d. The ventral view of parent shrimp without eggs; e. The ventral view of parent shrimp after 1 d of ovulation, showing fertilized ovum; f. The ventral view of parent shrimp after 10 d of ovulation, showing eye spot. Es: eye spot; Fo: fertilized ovum. |
|
|
表 1 不同光照条件对红条鞭腕虾抱卵率的影响 Tab.1 Egg-holding rate of Lysmata vittata under different light condition |
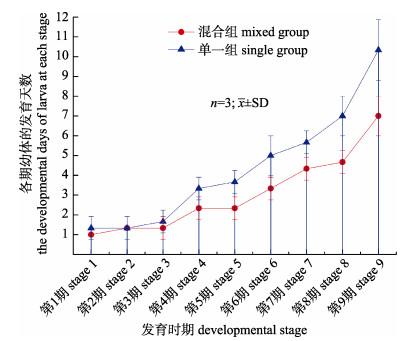
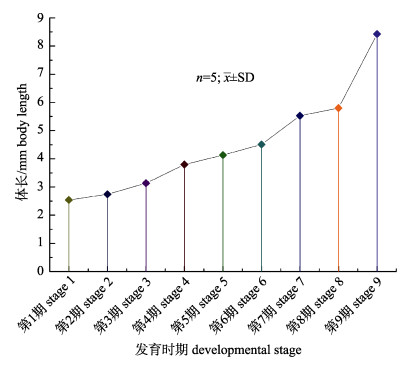
本实验投喂丰年虫和蒙古裸腹溞混合组的红条鞭腕虾溞状幼体在25 ℃温度条件下, 经过9次变态, 历经25~29 d全部发育成仔虾(图 2)。第1期至第6期的幼体变态发育比较规律, 每次蜕皮都伴随着1次变态, 前3期每1~2 d变态1次, 之后3期每2~4 d变态1次。从第6期后蜕皮时间逐渐延长到4~8 d, 且这段时期会出现滞育现象, 表现为幼体仅蜕皮但不变态, 或者是长时间的不蜕皮不变态, 直至幼体死亡。只投喂丰年虫单一组的红条鞭腕虾溞状幼体发育时间长于混合组, 在25 ℃温度条件下, 经37~41 d全部发育成仔虾(图 2)。同样, 投喂丰年虫单一组第1期至第6期的幼体每次蜕皮都伴随着1次变态, 前3期每1~2 d变态1次, 之后3期每3~6 d变态1次, 第6期后蜕皮时间逐渐延长到5~12 d。混合组和单一组的仔虾存活率分别为(38.3±2.3)%和(26.8± 4.9)%, 混合组虾苗的存活率显著高于单一组(P < 0.05, 表 2)。红条鞭腕虾幼体在变态发育过程中体长从(2.54±0.05) mm增长到(8.43±0.05) mm, 平均每天增长0.14~0.24 mm(图 3)。
|
图 2 红条鞭腕虾幼体变态发育图 Fig.2 Larval metamorphosis of Lysmata vittata |
|
|
表 2 不同饵料对红条鞭腕虾仔虾存活率的影响 Tab.2 Survival rate of Lysmata vittata larvae fed with different diets |
|
图 3 红条鞭腕虾幼体体长发育图 Fig.3 Larval growth of Lysmata vittata |
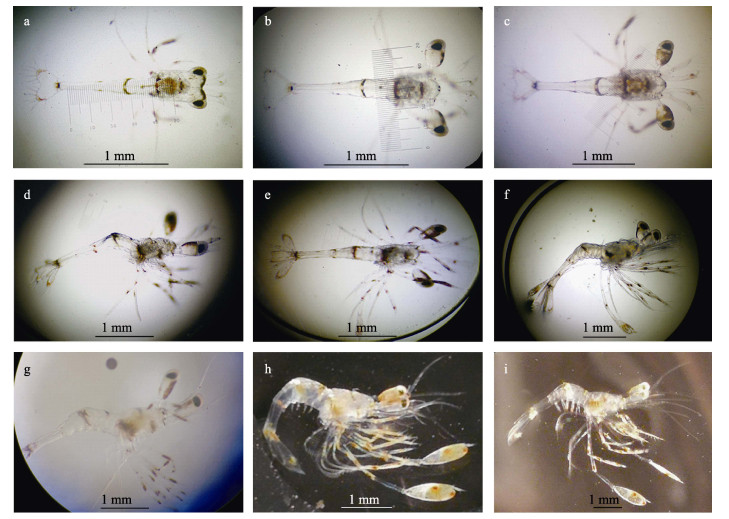
由图 4和表 3可知, 红条鞭腕虾的幼体发育主要经历9个不同时期:
|
图 4 红条鞭腕虾幼体发育各时期形态图 a.第1期; b.第2期; c.第3期; d.第4期; e.第5期; f.第6期; g.第7期; h.第8期; i.第9期. Fig.4 Morphological character of Lysmata vittata larva at different development stages a. Stage 1; b. Stage 2; c. Stage 3; d. Stage 4; e. Stage 5; f. Stage 6; g. Stage 7; h. Stage 8; i. Stage 9. |
|
|
表 3 红条鞭腕虾幼体发育情况表 Tab.3 The development of Lysmata vittata larvae |
第1期:身体狭长, 全长(2.54±0.05) mm, 复眼无眼柄, 有两对触角, 第一触角双肢型, 第二触角单肢型。腹部分6节, 第三节和第四节的交界处有红色条纹, 有3对颚足和2对步足, 第二步足为单肢萌芽, 尾节呈三角形, 中间凹陷, 边缘略有红色斑块, 每个圆形凸起处有7根羽状刚毛(图 4a)。
第2期:身体狭长, 全长(2.74±0.05) mm, 与第1期幼体最大的差别就是出现眼柄, 第二步足出现双肢萌芽, 其余特征同第1期(图 4b)。
第3期:全长(3.13±0.06) mm, 复眼有眼柄, 第三节和第四节交界处有少许红色条纹, 尾节边缘略有红色斑块, 各附肢末端有稍许红色斑块。第二步足基本发育, 第五步足呈单肢萌芽。从第六腹节分离出一对双肢型侧支, 其内肢刚萌芽较为细小, 外肢比内肢粗壮, 尾节呈三角形, 中间凹陷, 每个圆形凸起处有8根羽状刚毛(图 4c)。
第4期:全长(3.80±0.04) mm, 复眼有眼柄, 第一触角基部分2节, 第二触角特化成鳞片, 鳞片基部有一根细短的羽状刚毛。第三节和第四节交界处有少许红色条纹, 尾节边缘和各附肢末端略有红斑, 第五步足末端有大块红色斑块。第三步足呈双肢萌芽, 第五步足初步发育。尾肢为双肢, 内肢长度约为尾节的1/2(图 4d)。
第5期:全长(4.13±0.03) mm, 复眼有眼柄, 第一触角基节分2节, 接缝处有成对的羽状刚毛。第三、四节交界处有少许红纹, 尾节边缘与各附肢末端略有红色斑块。第五步足末端有大块红色斑块。第二步足发育完全, 第三步足初步发育并呈双肢, 第四步足双肢萌芽。第五步足倒数第一节为明显的浆状掌节, 末端可见红色斑块。尾肢内肢长度与尾节相等, 尾节侧边呈平行状, 中间凹陷(图 4e)。
第6期:全长(4.51±0.04) mm, 复眼有眼柄, 第一触角基节分2节, 内外肢分节。第二触角特化成鳞片, 其基部有细长突起。第三、四节交界处有红纹, 尾节边缘和各附肢末端的斑块呈红色, 第五步足末端有大块红色斑块, 斑块有些许黑点。五对步足发育完全。尾肢内肢短于外肢, 内肢长度长于尾节。尾节侧边呈平行状(图 4f)。
第7期:全长(5.53±0.03) mm, 复眼有眼柄, 第一触角基节分2节, 外肢分12节。第二触角双肢, 外肢特化成微鳞片。第三节和第四节交界处、尾节边缘以及各附肢末端有红色斑块, 第二、三、四步足的倒数第二节呈扁平状, 第五步足分4节, 末端有红斑, 顶端有一小刺。腹部出现明显凸起, 见图 4g。
第8期:全长(5.80±0.04) mm, 复眼有眼柄, 第一触角基节分2节, 内外肢各分35节以上。第二触角双肢型, 外肢特化为鳞片。第三、四节的交界处, 尾节边缘和各附肢的末端有红色斑块, 第五步足末端红色斑块较大。腹部的凸起进一步发育为腹肢(图 4h)。
第9期:全长(8.43±0.05) mm, 复眼有眼柄, 第一触角基节分两节, 内外肢各分35节以上。第二触角双肢型, 触鞭是鳞片的三倍长。第三、四节的交界处, 尾节边缘, 各附肢末端, 以及第五步足末端均有红色斑块。头胸甲较宽大, 身体粗壮, 腹肢发育成双肢型(图 4i)。
3 讨论 3.1 光照强度对红条鞭腕虾亲虾抱卵率的影响光照是除营养外影响虾蟹类繁殖与幼体培育的重要因素[9-12]。目前仍没有关于红条鞭腕虾亲虾繁育光照需求的研究报道。本实验通过对红条鞭腕虾亲虾进行不同的光照处理, 发现全暗(黑)组亲虾均不抱卵, 正常光照组与全暗(黑)组亲虾的抱卵率存在显著差异, 表明光照强度能够影响红条鞭腕虾亲虾的抱卵率。国内外研究表明, 健康虾蟹类生殖期亲体的光照状况对其生殖力、性腺的发育成熟、受精卵的孵化率有极大的影响。有研究发现强光抑制墨吉对虾(Penaeus merguiensis)卵巢的成熟并降低产卵量, 而弱光却能加速其卵巢发育成熟及促进产卵量, 表明光照强度在墨吉对虾卵巢成熟以及产卵过程中发挥重要作用[13]。王家伟[5]采用不等重复双因素完全随机试验设计方法测得50 lx和12L:12D的光照条件能够缩短清洁虾的性腺发育周期, 并提高其怀卵量和受精卵质量。因此, 选择合适的光照条件是成功培育亲虾的一个关键因素, 并对亲虾的性腺发育与繁殖性状起决定性作用。
3.2 饵料营养对红条鞭腕虾幼体成活率及生长发育周期的影响饵料营养是虾苗幼体培育的关键因素之一。第l期溞状幼体的机械虾(Lysmata wurdemanni)能够以体内残留的卵黄为生, 在没有食物的情况下只能变态至第2期; 若从幼体孵化后就投喂以足量的丰年虫无节幼体, 其幼体的成活率10% [14]。在对火焰虾(Lysmata debelius)的研究中也同样发现, 在其幼体刚孵化时就投喂藻类或丰年虫无节幼体能够提高幼体的成活率[15]。Zhang等[16]分别以硅藻、轮虫和丰年虫无节幼体为开口饵料来投喂机械虾溞状幼体, 发现完全投喂硅藻17 d后幼体全部死亡, 而投喂轮虫和丰年虫无节幼体组的溞状幼体的存活率没有显著差异, 但丰年虫无节幼体组的变态期显著短于轮虫组。从营养角度分析, 卤虫无节幼体营养价值最高, 轮虫营养价值居中, 而硅藻营养价值最低, 因此动物性蛋白含量对机械虾溞状幼体的早期存活起到关键性作用[16]。本实验通过投喂不同的生物饵料研究其对红条鞭腕虾溞状幼体成活率及发育周期的影响, 发现投喂丰年虫和蒙古裸腹溞混合组的红条鞭腕虾溞状幼体的成活率显著高于只投喂丰年虫单一组, 且其幼苗的发育周期也更短, 表明投喂丰年虫和蒙古裸腹溞混合饵料比只投喂丰年虫饵料更有利于幼体的存活和发育。此外, 本研究还发现红条鞭腕虾幼体的发育周期明显短于其他鞭腕虾属的虾类[3-6]。
3.3 红条鞭腕虾幼体发育各期主要特征本研究发现, 第1期的红条鞭腕虾溞状幼体复眼无眼柄, 从第2期开始出现眼柄。第3期的幼体从第六腹节生长出一对双肢型的尾肢, 内肢细短, 趋光性不好和运动能力弱的幼体很难发育到该期。第4期幼体的尾肢内肢为尾节的一半, 并出现浆状第五步足, 发育后期第五步足长于幼体的体长, 幼体拖着一对浆状步足呈倒游姿势运动。有研究发现缺失第五步足对幼体的游泳能力没有显著影响, 但会影响幼体的行走, 并指出第五步足的作用是支撑、运动和护食[17]。第1~4期幼体的尾节呈三角形, 而发育至第5~9期幼体的尾节呈长方形。第5期幼体的尾肢内肢长度进一步增加, 几乎与尾节同长。第6期幼体的尾肢内肢长度长于尾节, 从该期开始如果遇到不适宜的养殖条件, 幼体会出现滞育现象, 幼体期将会延长[18]。有研究指出鞭藻虾属的幼体发育滞育现象同样出现在自然环境中[19]。第1~6期幼体的第二触角均为单肢。从第7期后, 幼体的第二触角为双肢型, 外肢发育为触鞭, 腹部出现明显的凸起。第8期幼体的腹部出现单肢型腹肢。第9期幼体的腹肢进一步发育, 呈双肢型。
| [1] |
Xu P. Study on the taxonomy and zoogeography of the Hippolytidae (Crustacea: Decapoda) of China seas[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2014: 66-71. [许鹏.中国海域藻虾科(Hippolytidae)系统分类学和动物地理学研究[D].青岛: 中国科学院研究生院海洋研究所, 2014: 66-71.]
|
| [2] |
Abdelsalam K M. First record of exotic lysmatid shrimp Lysmata vittata (Stimpson, 1860) (Decapoda:Caridea:Lysmatidae) from the Egyptian Mediterranean coast[J]. Mediterranean Marine Science, 2018, 19(1): 124-131. DOI:10.12681/mms.15591 |
| [3] |
Yu W. Larval breeding and morphology of the marine ornamental shrimp: Lysmata rathbunae (peppermint shrimp)[D]. Shanghai: Shanghai Fisheries University, 2006: 1-64. [于帏.海洋观赏虾类Lysmata rathbunae(薄荷虾)的幼体培育和形态观察[D].上海: 上海水产大学, 2006: 1-64.] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1995173
|
| [4] |
Liu Y Y. Influence of several diets to reproductive performance of broodstocks and larval quality, a marine ornamental shrimp Lysmata amboinensis[D]. Shanghai: Shanghai Ocean University, 2009: 1-35. [刘元英.几种饵料对观赏虾Lysmata amboinensis亲虾繁殖性能与幼体质量的影响[D].上海: 上海海洋大学, 2009: 1-35.] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1575740
|
| [5] |
Wang J W. Effects of light and temperature on reproduction performance and egg quality of Lysmata amboinensis[D]. Shanghai: Shanghai Ocean University, 2011: 1-45. [王家伟.光照和温度对Lysmata amboinensis亲虾繁殖性能与受精卵质量的影响[D].上海: 上海海洋大学, 2011: 1-45.] http://cdmd.cnki.com.cn/Article/CDMD-10264-1011304909.htm
|
| [6] |
Zhang Y J. Morphological observation of embryonic development and larval morphology of marine ornamental shrimp Lysmata amboinensis[D]. Shanghai: Shanghai Ocean University, 2012: 1-34. [张雅静.海洋观赏虾类清洁虾(Lysmata amboinensis)胚胎发育及幼体的形态学观察[D].上海: 上海海洋大学, 2012: 1-34.] http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000235.htm
|
| [7] |
Bauer R T, Holt G J. Simultaneous hermaphroditism in the marine shrimp Lysmata wurdemanni (Caridea:Hippolytidae):An undescribed sexual system in the decapod Crustacea[J]. Marine Biology, 1998, 132(2): 223-235. DOI:10.1007/s002270050388 |
| [8] |
Coakes S J, Ong C. SPSS Version 18.0 for Windows:Analysis without Anguish[M]. Queensland: John Wiley & Sons Australia, 2011.
|
| [9] |
Luo W, Zhao Y L, Wang Q, et al. Effects of photoperiod on reproduction performance and egg quality of Cherax quadricarinatus[J]. Journal of Fisheries of China, 2004, 28(6): 675-681. [罗文, 赵云龙, 王群, 等. 光照对红螯螯虾繁殖性能及其受精卵卵质的影响[J]. 水产学报, 2004, 28(6): 675-681.] |
| [10] |
Guo B. The effects of light and temperature fluctuations on the molting, growth of Litopenaeus vannamei and its mechanisms[D]. Qingdao: Ocean University of China, 2010: 1-111. [郭彪.光照和温度波动对凡纳滨对虾(Litopenaeus vannamei)蜕皮和生长的影响及机制的初步研究[D].青岛: 中国海洋大学, 2010: 1-111.] http://cdmd.cnki.com.cn/Article/CDMD-10423-1011030425.htm
|
| [11] |
Ou H S, Liang H F. Effect of light on the larval metamorphosis of Litopenaeus vannamei[J]. Marine Sciences, 2017, 41(3): 55-60. [欧黄思, 梁华芳. 光照对凡纳滨对虾幼体变态发育的影响[J]. 海洋科学, 2017, 41(3): 55-60.] |
| [12] |
Zhang S F, Jiang K J, Gu X L, et al. Effects of light intensity on growth and energy budget of the larvae of Scylla paramamosain[J]. Marine Fisheries, 2011, 33(2): 187-194. [张胜负, 蒋科技, 顾孝连, 等. 光照强度对拟穴青蟹幼体生长及能量收支的影响[J]. 海洋渔业, 2011, 33(2): 187-194. DOI:10.3969/j.issn.1004-2490.2011.02.010] |
| [13] |
Hoang T, Lee S Y, Keenan C P, et al. Ovarian maturation of the banana prawn, Penaeus merguiensis de Man under different light intensities[J]. Aquaculture, 2002, 208(1-2): 159-168. DOI:10.1016/S0044-8486(01)00713-X |
| [14] |
Zhang D, Lin J D, LeRoy Creswell R. Ingestion rate and feeding behavior of the peppermint shrimp Lysmata wurdemanni on Artemia nauplii[J]. Journal of the World Aquaculture Society, 1998, 29(1): 97-102. DOI:10.1111/j.1749-7345.1998.tb00305.x |
| [15] |
Simoes F, Ribeiro F, Jones D A. Feeding early larval stages of fire shrimp Lysmata debelius (Caridea, Hippolytidae)[J]. Aquaculture International, 2002, 10(5): 349-360. DOI:10.1023/A:1023366423144 |
| [16] |
Zhang D, Lin J D, LeRoy Creswell R. Effects of food and temperature on survival and development in the peppermint shrimp Lysmata wurdemanni[J]. Journal of the World Aquaculture Society, 1998, 29(4): 471-476. DOI:10.1111/j.1749-7345.1998.tb00671.x |
| [17] |
Rufino M M, Jones D A. Observations on the function of the fifth pereiopod in late stage larvae of Lysmata debelius (Decapoda, Hippolytidae)[J]. Crustaceana, 2001, 74(9): 977-990. DOI:10.1163/15685400152682719 |
| [18] |
Yang H J, Kim C H. Zoeal stages of Lysmata vittata (Decapoda:Caridea:Hippolytidae) reared in the laboratory[J]. Animal Systematics, Evolution and Diversity, 2010, 26(3): 261-278. DOI:10.5635/KJSZ.2010.26.3.261 |
| [19] |
Heegaard P. Larvae of Decapod Crustacea[R]. The Carlsberg Foundation. DANA Report, 1969, 77: 1-82.
|
 2020, Vol. 27
2020, Vol. 27

