2. 中国水产科学研究院淡水渔业研究中心, 农业农村部淡水渔业和种质资源利用重点实验室, 江苏 无锡 214081
2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture and Rural Affairs; Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
池塘工程化循环水养殖系统(in-pond raceway aquaculture systems, IPRS)是集新型养殖设施与工程化技术于一体的一种新型养殖模式[1]。目前有关池塘工程化循环水养殖模式的研究主要集中在系统构建、优化与养殖种类筛选[2]、放养密度[3]、肌肉品质评价[4]以及水质净化处理技术[5-6]等方面, 新养殖模式实现了水资源循环利用和营养物质多级利用, 从而为鱼类创造适宜的生长条件。
鱼类的生长受许多因素的影响, 包括饲料粒径和类型、投喂频率、投喂量、饲料摄入量和吸收营养的能力等, 其中, 投喂频率是影响鱼类生长的关键因素之一[7]。很多研究结果表明, 在养殖过程中, 适当的投喂频率能够提高饲料利用率、促进生长、降低个体分化差异、减少饲料浪费和代谢废物排放对水环境的污染, 从而提高养殖利润[4-7], 而投喂频率过高或过低往往会导致鱼类生长率降低, 规格参差不齐, 还会积累破坏水质的废物, 降低其对病害的抵抗力[7-11]。大多数研究集中在投喂频率与生长率之间的关系, 然而, 鲜有研究关注池塘工程循环水养殖系统下投喂频率对生长相关基因表达的影响。大口黑鲈(Micropterus salmoides)因其具有抗逆性强、营养丰富、肉质鲜美等优点而倍受消费者青睐, 是淡水养殖中重要的经济鱼类之一。前期的研究结果表明, 大口黑鲈适合于池塘工程化循环水系统养殖, 产量达47.73 kg/m3[2], 然而新养殖模式下投喂频率对鱼类生长和生理等方面的研究尚属于空白。在生产中, 存在饲料投喂频率过高或过低的情况, 这可能会降低生产效益、增加养殖成本, 还可能会影响净化区域尾水的净化效率。随着大口黑鲈循环水养殖产业的快速推进, 对科学投喂饲料的要求也日益提高。鉴于此, 本试验通过研究流水槽循环水养殖模式下投喂频率对大口黑鲈生长、生理及肝脏GH和IGF-Ⅰ相对表达丰度的影响, 以确定池塘工程化循环水系统养殖大口黑鲈的适宜投喂频率, 为池塘工程化循环水养殖大口黑鲈的投喂管理提供参考。
1 材料与方法 1.1 试验鱼试验在中国水产科学研究院淡水渔业研究中心扬中基地池塘工程化流水槽循环水养殖系统内进行, 试验用大口黑鲈苗种由苏州金澄福渔业科技有限公司提供。选用同一批受精卵孵化、规格一致、健康的大口黑鲈幼鱼, 初始体重为(5.0±0.4) g, 体长(5.9±0.5) cm。
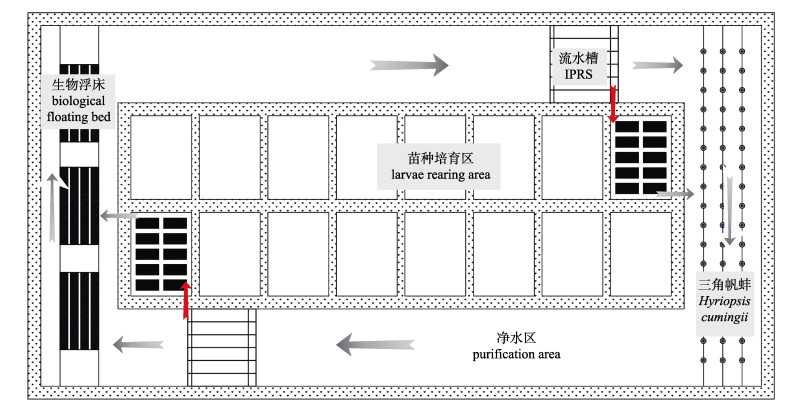
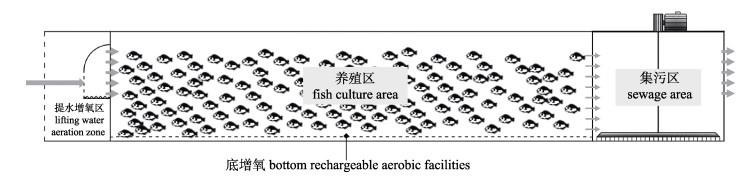
1.2 池塘工程化循环水养殖系统如图 1、图 2所示, 流水槽分为气提推水增氧区(5 m×1.2 m×1.2 m)、养殖区(22 m×5 m×2.5 m)和集污区(5 m×3 m×2.5 m)。流水槽前端安装气提推水增氧装置; 养殖区底部安装增氧设施。净化区约占池塘总面积的97%, 主要通过物理沉淀法、浮床栽种空心菜、薄荷和鱼腥草以及放养花白鲢和三角帆蚌对养殖尾水进行净化处理。养殖水源为长江水, 符合《渔业水质标准》(GB 11607-89)。
|
图 1 池塘工程化循环水养殖系统结构示意图 Fig.1 Diagram of the in-pond raceway systems (IPRS) |
|
图 2 流水养殖槽剖面示意图 Fig.2 Profile diagram of in-pond raceway systems (IPRS) |
试验随机分为3个投喂频率组(2次/d、3次/d和4次/d), 每个处理组设3个重复, 放养密度为20000尾/槽。正式试验前, 将试验鱼在养殖系统中进行2周的驯养, 使之逐步适应养殖条件和饲料。
1.4 饲养管理试验期间, 投喂鲈专用膨化颗粒饲料(浙江欣欣天恩水产饲料有限公司, 粗蛋白含量≥ 47%, 粗脂肪含量≥5%)。投喂频率与时间分别为2次/d组(6:00, 18:00), 3次/d组(6:00, 12:00, 18:00)和4次/d组(6:00, 10:00, 14:00, 18:00)。饱食投喂, 每次持续投喂约30 min, 投喂2 h后开启集排污系统清除残饵和粪便。饲料粒径根据鱼体规格而定。试验期间, 24 h持续气提推水增氧, 采用多参数水质实时在线检测分析仪(Tethys, 法国)监测水质状况, 溶氧≥4.0 mg/L, 水温为20~32 ℃, 氨氮 < 0.03 mg/L, 亚硝酸盐 < 0.02 mg/L, pH为7.5~8.6。试验周期为120 d。
1.5 样品采集分别在养殖的第30天、60天、90天和120天采集样品, 采样前禁食24 h。采样时, 每个重复随机取20尾鱼, 用MS-222快速麻醉, 称重、测量体长等。每个重复随机取20尾鱼于尾静脉取血, 4 ℃冰箱中静置4 h后, 离心15 min (4500 r/min、4 ℃), 收集血清‒80 ℃保存。迅速解剖, 取出肠道、肌肉、肝脏等组织, 液氮速冻后于‒80 ℃保存待用。
1.6 生理指标分析采用全自动生化分析仪(迈瑞BS-400, 深圳)测定血清总蛋白(TP)、总胆固醇(TC)、血糖(Glu)、甘油三酯(TG)、天门冬氨酸氨基转移酶(AST)、谷氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)等血清生化指标; 血清皮质醇和溶菌酶含量采取酶联免疫检测法(ELISA)测定。肝脏总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活性、总抗氧化能力(T-AOC)以及丙二醛(MDA)含量的测定采用南京建成生物工程研究所生产试剂盒进行测定。
1.7 肝脏GH、IGF-Ⅰ基因表达量的测定按照TaKaRa MiniBEST Universal RNA Extraction Kit试剂盒说明书提取肝脏的总RNA, 通过电泳检测RNA的完整性。采用TaKaRa Prime ScriptTM 1st strand cDNA Synthesis Kit反转录试剂盒合成cDNA, 并置于‒20 ℃保存待用。应用Primer Premier 5.0设计引物, 根据NCBI获得的大口黑鲈转录组数据及其相关基因的全长序列设计特异性引物, 所有引物均由苏州金唯智生物科技有限公司合成, 扩增片段长度为100~150 bp (表 1)。
|
|
表 1 实时定量PCR引物 Tab.1 Gene-specific real-time quantitative PCR primers |
GH、IGF-Ⅰ、18S和β-actin基因的表达量采用TaKaRa TB Green TM Fast qPCR Mixc测定, 进行RT-PCR反应, 然后采用SYBR GreenⅠ嵌合荧光法进行实时定量PCR扩增反应, 荧光定量PCR反应条件为: 95 ℃ 30 s; 然后40个循环: 95 ℃ 5 s, 58 ℃ 10 s, 熔解的反应条件为65~95 ℃。反应结束后确认RT-PCR的扩增曲线和熔解曲线。以β-actin和18S为内参, 对得到的各样品Ct值进行均一化处理, 以2次/d组各基因的mRNA水平为基准, 应用2-△△Ct法确定不同频率组相对应mRNA的相对表达量。
1.8 计算公式计算公式如下:
增重率(WGR, %)=100×(终末均重‒初始均重)/初始均重
特定生长率(SGR, %/d)=100×(ln终末均重‒ ln初始均重)/试验天数
肝体比(HSI, %)=100×肝胰脏重/体重
脏体比(VSI, %)=100×内脏重/体重
肥满度(CF, %)=100×体重/体长3
成活率(SR, %)=100×终末鱼的尾数/初始鱼的尾数
体重变异系数(CV, %)=100×样本标准差/样本平均值
饲料系数(FCR)=摄食量/(终末体重‒初始体重)
1.9 数据处理采用SPSS22.0软件进行数据统计分析。先对试验数据进行单因素方差分析(one-way ANOVA), 若差异显著(P < 0.05), 再进行LSD和Tukey氏法多重比较。数据均以平均值±标准误(x±SE)表示。
2 结果与分析 2.1 投喂频率对大口黑鲈生长的影响试验期间, 大口黑鲈能很快适应养殖环境和饲料, 没有出现病害和明显死亡, 成活率为90.07%~ 92.01%。从表 2可以看出, 养殖前60 d, 大口黑鲈末体重、SGR、WGR、HSI和VSI在各试验组之间差异不显著(P > 0.05)。而在第90天时, 2次/d组试验鱼的生长显著高于4次/d组(P < 0.05), 与3次/d组无显著性差异; 第120天时, 2次/d组试验鱼的生长显著高于3次/d组和4次/d组(P < 0.05), 第90天和120天时, HSI和VSI随投喂频率的增加而增加, 4次/d组显著高于其他两组(P < 0.05);投喂频率对肥满度无显著影响(P > 0.05)。
|
|
表 2 投喂频率对大口黑鲈生长性能和形态指标的影响 Tab.2 Effects of feeding frequency on growth performance and somatic indices of Micropterus salmoides |
由表 3可知, 投喂频率对大口黑鲈血清ALT、AST、ALP活性、溶菌酶、皮质醇和TG含量无显著影响(P > 0.05);第30~90天时, 投喂频率对血清总蛋白含量无显著影响(P > 0.05), 而在第120天时, 2次/d组显著高于其他两组(P < 0.05);第60天、90天和120天时投喂2次/d的血糖含量显著高于其他两组(P < 0.05)。随着投喂频率的增加, 总胆固醇含量呈现升高的趋势。
|
|
表 3 投喂频率对大口黑鲈血清生化指标的影响 Tab.3 Effects of feeding frequency on serum biochemical indices of Micropterus salmoides |
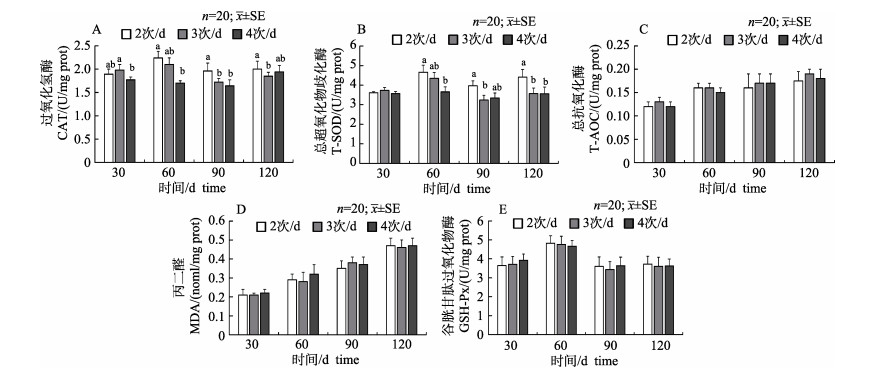
投喂频率对大口黑鲈肝脏抗氧化能力的影响见图 3。由图可知, 在第30天时, 3次/d组试验鱼肝脏CAT活性显著高于4次/d组(P < 0.05), 但与2次/d组差异不显著(P > 0.05);第60天时, 2次/d组CAT和T-SOD活性显著高于4次/d组(P < 0.05), 但与3次/d组差异不显著(P > 0.05), 第90天和120天时, 2次/d组CAT活性显著高于3次/d和4次/d组(P < 0.05), 3次/d和4次/d组差异不显著(P > 0.05);在第30天时, 各试验组T-SOD无显著差异(P > 0.05);在第60天、90天和120天时, T-SOD活力随着投喂频率的增加而降低; 投喂频率对肝脏T-AOC、GSH-Px活力及MDA含量无显著影响(P > 0.05)。
|
图 3 不同投喂频率对大口黑鲈肝脏抗氧化指标的影响
柱形图上方字母的不同表示差异显著(P < 0.05)
A.过氧化氢酶; B.总超氧化物歧化酶; C.总抗氧化能力; D.丙二醛; E.谷胱甘肽过氧化物酶 Fig.3 Effects of different feeding frequencies on liver antioxidant indies of Micropterus salmoides Different letters on the column indicate significant difference (P < 0.05). A. CAT; B. T-SOD; C. T-AOC; D. MDA; E. GSH-Px |
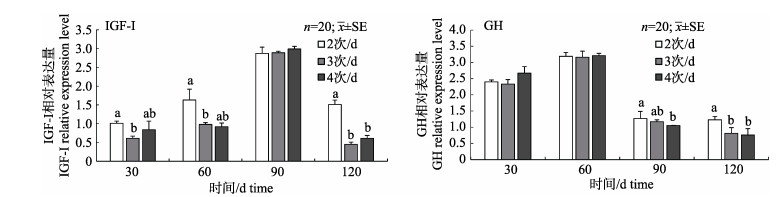
由图 4可知, 大口黑鲈肝脏中GH和IGF-Ⅰ基因的相对表达量受到投喂频率的影响。在第30天、60天、120天时, 2次/d组IGF-Ⅰ基因的相对表达量显著高于3次/d和4次/d组(P < 0.05), 而在第90天时, IGF-Ⅰ基因的相对表达量在各处理组间差异不显著(P > 0.05)。在第90天和120天时, 2次/d组GH基因表达量显著高于4次/d组, 而GH基因的相对表达量在第30天和60天时组间差异不显著(P > 0.05)。
|
图 4 不同投喂频率对大口黑鲈IGF-Ⅰ基因和GH基因相对表达量的影响 柱形图上方字母的不同表示差异显著(P < 0.05). Fig.4 Effects of feeding frequency on expressions of IGF-Ⅰ and GH in liver of Micropterus salmoides Different letters on the column indicate significant difference (P < 0.05). |
一般认为, 在一定范围内, 投喂频率的提高, 可以使鱼类摄食量增加, 进而提高鱼类的生长速度[7, 9, 11-14]。本研究中, 大口黑鲈成活率为90.07%~ 92.01%, 投喂频率对其无影响; 在0~60 d时, 2次/d、3次/d和4次/d的投喂频率对大口黑鲈终末体重、增重率、特定生长率和饲料系数无显著影响, 这表明投喂频率为2次/d时, 能够满足维持大口黑鲈生长和发育对营养和能量的需求。类似的, Webster等[15]对斑点叉尾鮰(Ictalurus punctatus)、Biswas等[16]对南亚野鲮(Cirrhinus mrigala)、Roy等[17]对蓝鳃太阳鱼(Lepomis macrochirus)的研究发现, 投喂频率对鱼类生长发育无影响。然而, 在本研究后期(第90~120天), 2次/d组试验鱼生长性能优于3次/d和4次/d组, 而对饲料系数无影响。Tian等[18]研究发现, 3次/d组团头鲂(Megalobrama amblycephala)末体重和增重率显著高于6次/d组; Tsevis等[19]研究亦发现, 4次/d投喂组舌齿鲈(Dicentrarchus labrax)的生长率降低; 高投喂频率引起的生长率降低可归结于以下三方面原因:一是由于有胃鱼类肠道较短, 投喂间隔过短会导致胃部负担过重, 食物未经完全消化, 排空速度加快, 使大量尚未充分消化的食物快速通过肠道排出, 影响营养物的消化吸收[20]; 二是养殖鱼类过多的索食行为运动消耗掉了部分能量, 从而生长速度缓慢; 三是高投喂频率会引起鱼类更高的攻击性接触率和社群交互作用, 进而会对其行为、生理及生长产生消极的影响[21-22]。投喂频率对生长的差异可能与鱼的种类和规格、投饲率、养殖环境、季节等条件的不同而存在差异。本研究中, 投喂频率对大口黑鲈体质量变异系数CV没有影响; 在一定程度上, 提高投喂频率可以有效地降低水产动物的体质量/体长变异系数, 尤其是在高密度饲养条件下[23-24]。
鱼类形体指标是衡量鱼体能量状态的间接指标[25]。在本研究中, 在60~120 d时, 4次/d组大口黑鲈的脏体比和肝体比显著高于2次/d组和3次/d组。类似的, Guo等[7]对花羔红点鲑(Salvelinus malma)、王伟等[26]对花鲈(Lateolabrax maculatus)幼鱼、朱婷婷等[27]对虎斑乌贼(Sepia pharaonis)的研究发现, 脏体比或肝体比随投喂频率的增加而升高。通常是由于摄食量的增加, 脂肪经过转运后在肝脏和内脏积累引起的脏体比或肝体比升高[28-29]。而投喂频率对瓦氏黄颡鱼(Pelteobagrus vachelli)幼鱼肝体指数无显著影响[14]。
3.2 投喂频率对大口黑鲈生理指标的影响 3.2.1 投喂频率对大口黑鲈血清生化指标的影响血清生化指标可以作为是衡量鱼类机体代谢、营养水平和健康状况的重要参考指标。血清皮质醇是鱼类在应激状态下从下丘脑‒脑垂体‒肾间组织轴分泌的一种重要应激激素, 皮质醇升高可作为鱼类应激的敏感信号[30]。溶菌酶是白细胞释放的一种具有抗菌特性的酶, 是鱼类非特异性免疫功能的重要指标, 在鱼类的免疫应答和抗病性中起着重要作用[31]。本研究中, 投喂频率对血清皮质醇和溶菌酶水平无显著影响, 这表明不同的投喂频率未引起加州鲈产生应激胁迫, 未改变其免疫力和抗病力; 血清ALT和AST在蛋白质和氨基酸代谢中起着重要作用, 其在组织损伤和功能障碍时释放到血浆中, 二者含量可提供有关器官损伤和肝病严重程度的信息[32]。本研究发现, 投喂频率对血清ALT和AST水平无影响, 这表明投喂频率未引起肝功能受损。血清TP含量反映了机体对蛋白质吸收代谢和营养的状况, 同时与机体免疫有关[33]。本研究中, 血清TP含量在第30天、60天和90天时各组之间无显著性差异, 这与对花鳗鲡(Anguiua marmorata)研究结果相似。而在研究末期第120天时随着投喂频率的增加而降低, 这表明投喂频率过高在一定程度上抑制了鱼体内蛋白质合成代谢。血清TC和TG是反映鱼类脂类代谢的状况的指标, 含量过高意味着机体脂质代谢出现紊乱, 肝功可能受损[34]。本研究中, 血清TG含量不受投喂频率的影响, 而4次/d组试验鱼血清TC含量要高于其他两组; 刘伟等[11]对吉富罗非鱼(Oreochromis niloticus)幼鱼的结果亦表明, TC水平随投喂频率的增加而显著升高, 这说明投喂频率过高更易于将多余的营养物质转化为脂肪积累在鱼体内。鱼体Glu含量受胰岛素、肾上腺素和糖代谢酶等的调节, 一般处于一种动态平衡状态, 且极易随外界因子的改变而发生变化[33]。本次研究中, 在第60~120天时3次/d和4次/d组Glu含量显著低于2次/d组, 林艳等[13]对团头鲂研究也得到了相似结果, 这可以解释为鱼类在多次投喂条件下增加了营养及能量物质摄入, 刺激了胰岛素的持续分泌, 改善了糖代谢水平, 体内经过自我调节趋于新的稳态。
3.2.2 投喂频率对大口黑鲈抗氧化能力的影响动物机体在进行物质代谢和抵御外界侵袭时会产生一些自由基[35]。除了哺乳动物, 鱼类比其他脊椎动物更容易受到氧化损伤。SOD、CAT和GSH-Px是主要的酶抗氧化系统, 这些抗氧化酶可清除过量自由基, 以维持动物体内氧化和抗氧化处于一种动态平衡[36]; T-AOC是反映机体抗氧化能力的一个非常好的指标。MDA是生物体内自由基作用于脂质发生过氧化反应的最终产物, 其含量可反映机体内活性氧的水平及氧化损伤的程度, 可作为评价体内清除自由基能力和组织氧化损伤情况的指标[37]。近年来, 有关投喂频率与鱼类氧化应激之间的关系关注较少。CAT和SOD是重要的抗氧化防御系统, 是抗氧化酶防御的第一道防线[38]。在本研究中, 投喂2次/d的大口黑鲈肝脏CAT和T-SOD活力显著高于投喂4次/d组, 这表明高投喂频率降低了大口黑鲈的抗氧化能力, 这可能是抑制生长的一个原因。Li等[36]研究发现, 随着喂养频率从1次/d增加到3次/d, 团头鲂肝脏CAT、GPX活性显著下降, 随着喂养频率的进一步增加, 肝脏CAT、GPX活性显著增加, 而T-AOC则相反。与之相反的是有研究者对日本沼虾(Macrobrachium nipponense)[39]和凡纳滨对虾(Litopenaeus vannamei)[40]的研究结果显示, 高投喂频率(6次/d)显著提高SOD和CAT活性。这可能跟养殖种类和养殖环境有关。Guo等[7]研究表明, 不同投喂频率对花羔红点鲑SOD和CAT无显著影响, T-AOC随投喂频率由1次/d增加到5次/d而显著增加, 但5次/d时显著下降, MDA含量随投喂频率的增加而显著增加, 这表明不适宜的投喂频率都可能会引起氧化应激反应, 进而对鱼类的生长造成负面影响。本研究中, 不同投喂频率组大口黑鲈肝脏MDA、GSH-Px和T-AOC无明显差异, 这与窦艳君等[41]对点带石斑鱼的研究结果相似。而有的研究发现, 花羔红点鲑[7]血清MDA、团头鲂[36]和日本沼虾[39]肝脏MDA水平随着投喂频率的增加而显著增加。投喂频率对养殖动物抗氧化能力结果的差异可能与养殖动物种类、生理状态、组织部位、养殖条件的不同有关。
3.3 投喂频率对大口黑鲈肝脏中GH、IGF-Ⅰ基因表达丰度的影响鱼类的生长受到生长激素(GH)、类胰岛素生长因子(IGF-Ⅰ和IGF-Ⅱ)轴的相关基因的调控[42], GH和IGF-Ⅰ基因相对表达量的观测有助于从分子和内分泌水平上更加深入解释鱼类生长的研究[43]。GH是鱼类等脊椎动物腺垂体分泌的参与众多生理过程的内分泌调节因子, 主要参与渗透平衡、蛋白质、脂类和糖类代谢、繁殖和生长等生理过程。此外, GH还会影响食欲和觅食行为。GH首先和细胞膜上的特异性受体相结合, 才能在组织与细胞水平起作用, 这些生长激素的特异受体主要分布在肝脏。GH能刺激IGF-Ⅰ的合成, 肝脏是鱼类IGF转录的主要部位[44]。虽然IGF-Ⅰ、GH表达量广泛存在于鱼体各种组织中, 但许多硬骨鱼类IGF-Ⅰ具有高表达量在肝脏中如鲫(Carassius auratus auratus)[45]、智利比目鱼(Paralichthys adspersus)[46]和河鲀(Tadifugu obsus)[47]等。本研究中用实时PCR分析显示大口黑鲈IGF-Ⅰ、GH最高转录物的量在肝脏中, 结果与其他硬骨鱼类的发现一致。这说明用肝脏组织检测IGF-Ⅰ、GH表达量来反映鱼类的生长状况是可靠的。
目前, 有关投喂策略与鱼类GH/IGF-Ⅰ基因调节之间关系的研究关注较少。在本研究中, 在第30天和60天时, GH基因相对表达量在各组之间差异不显著, 而在第90天和120天时, GH基因的相对表达量随投喂频率的增加而降低, 这与本研究中加州鲈的生长结果一致。Tian等[18]在团头鲂的研究中发现, 随着投喂频率由1次/d增加到3次/d, 脑GH的表达量显著下降, 而后继续增加投喂频率对其表达无影响, 与其生长结果正好相反, 研究者对大口黑鲈[48]和金头鲷(Sparus aurata)[49]的研究亦发现, GH水平与生长率呈负相关关系。GH和生长的关系取决于饲料营养、循环GH的清除率、靶组织上GH受体数量和亲和力的变化以及与IGF-Ⅰ的相互作用等[50]。本研究中, 在30天、60天和120天时, 2次/d组肝脏IGF-Ⅰ基因的相对表达量最高, 与本实验不同的是, 随着投喂频率由1次/d增加到3次/d, 团头鲂脑IGF-Ⅰ基因的表达量显著增加, 而后显著降低[18]。鱼类IGF-Ⅰ是GH发挥促生长作用的重要中介因子。一般地, 鱼类血浆IGF-Ⅰ水平或肝细胞IGF-Ⅰ mRNA水平与生长率呈正相关关系[51]; 第90天时, IGF-Ⅰ基因相对表达量在组间差异不显著, 但是表达量上升, 这可能与高温季节影响IGF基因表达有关。环境温度升高能促进大鳞大麻哈鱼(Oncorhynchus tshawytscha)生长及IGF-Ⅰ的合成与分泌[52]; Hevrøy等[53]研究发现, 高温时虹鳟和大西洋鲑(Salmo salar)血浆IGF-Ⅰ mRNA的表达量有升高的趋势; 相反的是, 19 ℃时虹鳟肝脏中IGF-Ⅰ mRNA的表达显著降低于13 ℃时的表达量, 这意味着饲料摄入量减少引起虹鳟肌肉合成代谢信号减少, 进而影响生长; 而大西洋鲑的IGF-Ⅰ表达没有温度效应。本研究中, 大口黑鲈生长发育前期GH相对表达量高于后期, 这表明GH含量与生长阶段有关, Ma等[54]对半滑舌鳎(Cynoglossus semilaevis)的研究发现, 养殖前期生长激素释放激素的表达量高于养殖后期。
4 结论综上所述, 在池塘工程化循环水养殖条件下, 养殖前60 d, 投喂频率对初始体重为(5.0±0.4) g的大口黑鲈生长和生理无影响, 而在养殖后期, 投喂频率为2次/d时其生长率高、抗氧化能力优于3次/d和4次/d组, 综合考虑大口黑鲈的生长与健康, 建议池塘工程化循环水养殖大口黑鲈的投喂频率为2次/d。
| [1] |
Badiola M, Mendiola D, Bostock J. Recirculating Aquaculture Systems (RAS) analysis:Main issues on management and future challenges[J]. Aquacultural Engineering, 2012, 51: 26-35. DOI:10.1016/j.aquaeng.2012.07.004 |
| [2] |
Wang Y Y, Xu G C, Nie Z J, et al. Growth performance of bluntnose black bream, channel catfish, yellow catfish, and largemouth bass reared in the in-pond raceway recirculating culture system[J]. North American Journal of Aquaculture, 2019, 81(2): 153-159. DOI:10.1002/naaq.10082 |
| [3] |
Wang Y Y, Xu P, Nie Z J, et al. Growth, digestive enzymes activities, serum biochemical parameters and antioxidant status of juvenile genetically improved farmed tilapia (Oreochromis niloticus) reared at different stocking densities in in-pond raceway recirculating culture system[J]. Aquaculture Research, 2019, 50(4): 1338-1347. DOI:10.1111/are.14010 |
| [4] |
Harimana Y, Tang X, Le G W, et al. Quality parameters of black carp (Mylopharyngodon piceus) raised in lotic and lentic freshwater systems[J]. LWT, 2018, 90: 45-52. DOI:10.1016/j.lwt.2017.11.060 |
| [5] |
Wang J K. Conceptual design of a microalgae-based recirculating oyster and shrimp system[J]. Aquacultural Engineering, 2003, 28(1-2): 37-46. DOI:10.1016/S0144-8609(03)00020-7 |
| [6] |
Spiliotopoulou A, Rojas-Tirado P, Chhetri R K, et al. Ozonation control and effects of ozone on water quality in recirculating aquaculture systems[J]. Water Research, 2018, 133: 289-298. DOI:10.1016/j.watres.2018.01.032 |
| [7] |
Guo Z X, Cui J Y, Li M, et al. Effect of feeding frequency on growth performance, antioxidant status, immune response and resistance to hypoxia stress challenge on juvenile dolly Varden char Salvelinus malma[J]. Aquaculture, 2018, 486: 197-201. DOI:10.1016/j.aquaculture.2017.12.031 |
| [8] |
Kubitza F, Lovshin L L. Formulated diets, feeding strategies, and cannibalism control during intensive culture of juvenile carnivorous fishes[J]. Reviews in Fisheries Science, 1999, 7(1): 1-22. DOI:10.1080/10641269991319171 |
| [9] |
Sun R J, Zhang W B, Xu W, et al. Effects of dietary protein level and feeding frequency on the growth performance, body composition and protein metabolism of juvenile large yellow croakers, Pseudosciaena crocea R[J]. Acta Hydrobiologica Sinica, 2013, 37(2): 281-289. [孙瑞健, 张文兵, 徐玮, 等. 饲料蛋白质水平与投喂频率对大黄鱼生长, 体组成及蛋白质代谢的影响[J]. 水生生物学报, 2013, 37(2): 281-289.] |
| [10] |
Jobling M. Effect of feeding frequency on food intake and growth of Arctic charr, Salvelinus alpinus L[J]. Journal of Fish Biology, 1983, 23(2): 177-185. DOI:10.1111/j.1095-8649.1983.tb02892.x |
| [11] |
Liu W, Wen H, Jiang M, et al. Effects of dietary protein level and feeding frequency on growth and some physiological-biochemical indexes of GIFT strain of juvenile Nile tilapia (Oreochromis niloticus)[J]. Journal of Fisheries of China, 2016, 40(5): 751-762. [刘伟, 文华, 蒋明, 等. 饲料蛋白质水平与投喂频率对吉富罗非鱼幼鱼生长及部分生理生化指标的影响[J]. 水产学报, 2016, 40(5): 751-762.] |
| [12] |
Zhao S B, Han D, Zhu X M, et al. Effects of feeding frequency and dietary protein levels on juvenile allogynogenetic gibel carp (Carassius auratus gibelio) var. CAS Ⅲ:Growth, feed utilization and serum free essential amino acids dynamics[J]. Aquaculture Research, 2016, 47(1): 290-303. DOI:10.1111/are.12491 |
| [13] |
Lin Y, Miao L H, Ge X P, et al. Effects of feeding frequency on growth performance, muscle quality and plasma biochemical indices of Megalobrama amblycephala juvenile[J]. Chinese Journal of Animal Nutrition, 2015, 27(9): 2749-2756. [林艳, 缪凌鸿, 戈贤平, 等. 投喂频率对团头鲂幼鱼生长性能、肌肉品质和血浆生化指标的影响[J]. 动物营养学报, 2015, 27(9): 2749-2756. DOI:10.3969/j.issn.1006-267x.2015.09.013] |
| [14] |
Qin Z B, Zhao H X, Zhao H L, et al. Effects of feeding frequency on gastric evacuation, growth performance and body composition of juvenile darkbarbel catfish (Pelteobagrus vachelli Richardson)[J]. Oceanologia et Limnologia Sinica, 2011, 42(4): 506-511. [覃志彪, 赵海祥, 赵华林, 等. 投饲频率对瓦氏黄颡鱼(Pelteobagrus vachelli)幼鱼胃排空、生长效益及体组成影响[J]. 海洋与湖沼, 2011, 42(4): 506-511.] |
| [15] |
Webster C D, Tidwell J H, Tidwell J H, et al. Effect of protein level and feeding frequency on growth and body composition of cage-reared channel catfish[J]. The Progressive Fish-Culturist, 1992, 54(2): 92-96. DOI:10.1577/1548-8640(1992)054<0092:EOPLAF>2.3.CO;2 |
| [16] |
Biswas G, Jena J K, Singh S K, et al. Effect of feeding frequency on growth, survival and feed utilization in mrigal, Cirrhinus mrigala, and rohu, Labeo rohita, during nursery rearing[J]. Aquaculture, 2006, 254(1-4): 211-218. DOI:10.1016/j.aquaculture.2005.08.001 |
| [17] |
Roy L A, Rawles S D, Kelly A M, et al. Effect of winter feeding frequency on growth, survival, and fatty acid metabolism of juvenile bluegill (Lepomis macrochirus) and hybrid bluegill (L. cyanellus×L. macrochirus)[J]. Aquaculture, 2017, 479: 780-789. DOI:10.1016/j.aquaculture.2017.07.026 |
| [18] |
Tian H Y, Zhang D D, Li X F, et al. Optimum feeding frequency of juvenile blunt snout bream Megalobrama amblycephala[J]. Aquaculture, 2015, 437: 60-66. DOI:10.1016/j.aquaculture.2014.11.032 |
| [19] |
Tsevis N, Klaoudatos S, Conides A. Food conversion budget in seabass Dicentrarchus labrax, fingerlings under two different feeding frequency patterns[J]. Aquaculture, 1992, 101(3-4): 293-304. DOI:10.1016/0044-8486(92)90032-G |
| [20] |
Dwyer K S, Brown J A, Parrish C, et al. Feeding frequency affects food consumption, feeding pattern and growth of juvenile yellowtail flounder (Limanda ferruginea)[J]. Aquaculture, 2002, 213(1-4): 279-292. DOI:10.1016/S0044-8486(02)00224-7 |
| [21] |
Zhang Z H, Guo H Y, Zhang X M, et al. Fish social hierarchy and its application in aquaculture and stock enhancement[J]. Chinese Journal of Ecology, 2018, 37(4): 1257-1264. [张宗航, 郭浩宇, 张雪梅, 等. 鱼类社群等级及其在水产增养殖中的应用[J]. 生态学杂志, 2018, 37(4): 1257-1264.] |
| [22] |
de Barros I B A, Villacorta-Correa M A, Carvalho T B. Stocking density and water temperature as modulators of aggressiveness, survival and zootechnical performance in matrinxã larvae, Brycon amazonicus[J]. Aquaculture, 2019, 502: 378-383. DOI:10.1016/j.aquaculture.2018.12.070 |
| [23] |
Xia B, Ren Y C, Wang J Y, et al. Effects of feeding frequency and density on growth, energy budget and physiological performance of sea cucumber Apostichopus japonicus (Selenka)[J]. Aquaculture, 2017, 466: 26-32. DOI:10.1016/j.aquaculture.2016.09.039 |
| [24] |
Xie F J, Ai Q H, Mai K S, et al. The optimal feeding frequency of large yellow croaker (Pseudosciaena crocea, Richardson) larvae[J]. Aquaculture, 2011, 311(1-4): 162-167. DOI:10.1016/j.aquaculture.2010.12.005 |
| [25] |
Chellappa S, Huntingford F A, Strang R H C, et al. Condition factor and hepatosomatic index as estimates of energy status in male three-spined stickleback[J]. Journal of Fish Biology, 1995, 47(5): 775-787. DOI:10.1111/j.1095-8649.1995.tb06002.x |
| [26] |
Wang W, Zhang K Q, Wen H S, et al. Effects of feeding frequency on gastric evacuation, growth performance and body composition of juvenile Lateolabrax maculatus[J]. Periodical of Ocean University of China, 2018, 48(6): 55-62. [王伟, 张凯强, 温海深, 等. 投喂频率对花鲈幼鱼胃排空、生长性能和体组分的影响[J]. 中国海洋大学学报(自然科学版), 2018, 48(6): 55-62.] |
| [27] |
Zhu T T, Li C C, Lu Y, et al. Effects of feeding frequency on growth performance, body composition, digestive enzyme activities, tissue fatty acid and amino acid compositions of Sepia pharaonic[J]. Chinese Journal of Animal Nutrition, 2018, 30(9): 3581-3592. [朱婷婷, 李晨晨, 陆游, 等. 投喂频率对虎斑乌贼生长性能、体成分、消化酶活性、组织脂肪酸和氨基酸含量的影响[J]. 动物营养学报, 2018, 30(9): 3581-3592. DOI:10.3969/j.issn.1006-267x.2018.09.028] |
| [28] |
Aliyu-Paiko M, Hashim R. Effects of substituting dietary fish oil with crude palm oil and palm fatty acid distillate on growth, muscle fatty acid composition and the activities of hepatic lipogenic enzymes in snakehead (Channa striatus, Bloch 1793) fingerling[J]. Aquaculture Research, 2012, 43(5): 767-776. DOI:10.1111/j.1365-2109.2011.02888.x |
| [29] |
Tan C X. Effects of stocking density and feeding frequency on growth, body composition, digestive enzyme and blood biochemical of Anguilla marmorata in recirculating aquaculture system[D]. Shanghai: Shanghai Ocean University, 2016. [檀晨曦.循环水养殖模式下养殖密度和投喂频率对花鳗鲡生长性能、体组成、消化酶活性和血清生化指标的影响[D].上海: 上海海洋大学, 2016.] http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912278.htm
|
| [30] |
Mommsen T P, Vijayan M M, Moon T W. Cortisol in teleosts:dynamics, mechanisms of action, and metabolic regulation[J]. Reviews in Fish Biology and Fisheries, 1999, 9(3): 211-268. DOI:10.1023/A:1008924418720 |
| [31] |
Saurabh S, Sahoo P K. Lysozyme:an important defence molecule of fish innate immune system[J]. Aquaculture Research, 2008, 39(3): 223-239. DOI:10.1111/j.1365-2109.2007.01883.x |
| [32] |
Lin J D, Lin P Y, Chen L M, et al. Serum glutamic-oxaloacetic transaminase (GOT) and glutamic-pyruvic transaminase (GPT) levels in children and adolescents with intellectual disabilities[J]. Research in Developmental Disabilities, 2010, 31(1): 172-177. DOI:10.1016/j.ridd.2009.08.005 |
| [33] |
Zhou Y, Guo W C, Yang Z G, et al. Advances in the study of haemotological indices of fish[J]. Journal of Shanghai Fisheries University, 2001, 10(2): 163-165. [周玉, 郭文场, 杨振国, 等. 鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2): 163-165.] |
| [34] |
Bernet D, Schmidt H, Wahli T, et al. Effluent from a sewage treatment works causes changes in serum chemistry of brown trout (Salmo trutta L.)[J]. Ecotoxicology and Environmental Safety, 2001, 48(2): 140-147. DOI:10.1006/eesa.2000.2012 |
| [35] |
Azaza M S, Khiari N, Dhraief M N, et al. Growth performance, oxidative stress indices and hepatic carbohydrate metabolic enzymes activities of juvenile Nile tilapia, Oreochromis niloticus L., in response to dietary starch to protein ratios[J]. Aquaculture Research, 2015, 46(1): 14-27. DOI:10.1111/are.12153 |
| [36] |
Li X F, Tian H Y, Zhang D D, et al. Feeding frequency affects stress, innate immunity and disease resistance of juvenile blunt snout bream Megalobrama amblycephala[J]. Fish & Shellfish Immunology, 2014, 38(1): 80-87. |
| [37] |
Miller A F. Superoxide dismutases:Active sites that save, but a protein that kills[J]. Current Opinion in Chemical Biology, 2004, 8(2): 162-168. DOI:10.1016/j.cbpa.2004.02.011 |
| [38] |
Winston G W, di Giulio R T. Prooxidant and antioxidant mechanisms in aquatic organisms[J]. Aquatic Toxicology, 1991, 19(2): 137-161. DOI:10.1016/0166-445X(91)90033-6 |
| [39] |
Ding Z L, Kong Y Q, Zhang Y X, et al. Effect of feeding frequency on growth, body composition, antioxidant status and mRNA expression of immunodependent genes before or after ammonia-N stress in juvenile oriental river prawn, Macrobrachium nipponense[J]. Fish & Shellfish Immunology, 2017, 68: 428-434. |
| [40] |
Chen W X, Shen Y C, Li Z L, et al. The effect of feeding frequency on growth, digestive enzymes, immune enzyme and N budget of Litopenaeus vannamei[J]. Marine Sciences, 2013, 37(9): 49-53. [陈文霞, 申玉春, 李再亮, 等. 投喂频率对凡纳滨对虾生长、消化酶和免疫酶活力以及氮收支的影响[J]. 海洋科学, 2013, 37(9): 49-53.] |
| [41] |
Dou Y J, Xing K Z, Wang Q K, et al. Effects of feeding frequency on the growth and plasma antioxidant indices of Epinephelus malabaricus[J]. Fishery Modernization, 2016, 43(2): 1-6. [窦艳君, 邢克智, 王庆奎, 等. 投喂频率对点带石斑鱼生长和血浆抗氧化指标的影响[J]. 渔业现代化, 2016, 43(2): 1-6. DOI:10.3969/j.issn.1007-9580.2016.02.001] |
| [42] |
Walock C N, Kittilson J D, Sheridan M A. Characterization of a novel growth hormone receptor-encoding cDNA in rainbow trout and regulation of its expression by nutritional state[J]. Gene, 2014, 533(1): 286-294. DOI:10.1016/j.gene.2013.09.046 |
| [43] |
Chen N S, Zhou J, Jin L N, et al. Effects of fasting on growth and expression abundance of IGF-Ⅰ mRNA in largemouth bass (Micropterus salmoides)[J]. Journal of Fishery Sciences of China, 2010, 17(4): 713-720. [陈乃松, 周洁, 靳利娜, 等. 禁食对大口黑鲈生长和肝脏IGF-Ⅰ mRNA表达丰度的影响[J]. 中国水产科学, 2010, 17(4): 713-720.] |
| [44] |
Bertucci J I, Blanco A M, Sundarrajan L, et al. Nutrient regulation of endocrine factors influencing feeding and growth in fish[J]. Frontiers in Endocrinology, 2019, 10: 1-17. DOI:10.3389/fendo.2019.00001 |
| [45] |
Zhong H, Zhou Y, Liu S J, et al. Elevated expressions of GH/IGF axis genes in triploid crucian carp[J]. General and Comparative Endocrinology, 2012, 178(2): 291-300. DOI:10.1016/j.ygcen.2012.06.006 |
| [46] |
Escobar S, Fuentes E N, Poblete E, et al. Molecular cloning of IGF-1 and IGF-1 receptor and their expression pattern in the Chilean flounder (Paralichthys adspersus)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2011, 159(3): 140-147. DOI:10.1016/j.cbpb.2011.03.003 |
| [47] |
Cheng C H, Yang F F, Liao S A, et al. Effect of acute ammonia exposure on expression of GH/IGF axis genes GHR1, GHR2 and IGF-1 in pufferfish (Takifugu obscurus)[J]. Fish Physiology and Biochemistry, 2015, 41(2): 495-507. DOI:10.1007/s10695-015-0025-1 |
| [48] |
Chen N S, Jin L N, Zhou H Y, et al. Effects of dietary arginine levels and carbohydrate-to-lipid ratios on mRNA expression of growth-related hormones in largemouth bass, Micropterus salmoides[J]. General and Comparative Endocrinology, 2012, 179(1): 121-127. DOI:10.1016/j.ygcen.2012.08.004 |
| [49] |
Pérez-Sánchez J, Martí-Palanca H, Kaushik S J. Ration size and protein intake affect circulating growth hormone concentration, hepatic growth hormone binding and plasma insulin-like growth factor-Ⅰ immunoreactivity in a marine teleost, the gilthead sea bream (Sparus aurata)[J]. The Journal of Nutrition, 1995, 125(3): 546-552. |
| [50] |
Wu M J, Lu S D, Wu X Y, et al. Effects of dietary amino acid patterns on growth, feed utilization and hepatic IGF-Ⅰ, TOR gene expression levels of hybrid grouper (Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂) juveniles[J]. Aquaculture, 2017, 468: 508-514. DOI:10.1016/j.aquaculture.2016.11.019 |
| [51] |
Duan C M. Nutritional and developmental regulation of insulin-like growth factors in fish[J]. The Journal of Nutrition, 1998, 128(2): 306S-314S. DOI:10.1093/jn/128.2.306S |
| [52] |
Beckman B R, Larsen D A, Moriyama S, et al. Insulin-like growth factor-Ⅰ and environmental modulation of growth during smoltification of spring chinook salmon (Oncorhynchus tshawytscha)[J]. General and Comparative Endocrinology, 1998, 109(3): 325-335. DOI:10.1006/gcen.1997.7036 |
| [53] |
Hevrøy E M, Tipsmark C K, Remø S C, et al. Role of the GH-IGF-1 system in Atlantic salmon and rainbow trout postsmolts at elevated water temperature[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2015, 188: 127-138. |
| [54] |
Ma Q, Liu S F, Zhuang Z M, et al. Genomic structure, polymorphism and expression analysis of growth hormone-releasing hormone and pituitary adenylate cyclase activating polypeptide genes in the half-smooth tongue sole (Cynoglossus semilaevis)[J]. Genetics and Molecular Research, 2011, 10(4): 3828-3846. DOI:10.4238/2011.December.12.1 |
 2020, Vol. 27
2020, Vol. 27

