2. 广东省农业科学院动物卫生研究所, 广东省畜禽疫病防治研究重点实验室, 农业农村部兽用药物与诊断技术广东科学观测实验站, 广东 广州 510640
2. Key Laboratory of Livestock Disease Prevention of Guangdong Province; Scientific Observation and Experiment Station of Veterinary Drugs and Diagnostic Techniques of Guangdong Province, Ministry of Agriculture and Rural Affairs; Institute of Animal Health, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
锦鲤疱疹病毒病(KHVD)是由鲤疱疹病毒3型(Cyprinid herpesvirus 3, CyHV-3)引起的一种高传染性、致死性疾病, 近20年来, 在世界范围内流行, 严重威胁鲤(Cyprinus carpio)、锦鲤(Cyprinus carpio haematopterus)养殖业安全[1-2]。CyHV-3又称为鲤疱疹病毒(Koi herpesvirus, KHV), 疱疹病毒目(Herpesvirales), 疱疹病毒科(Herpesviridae), 鲤疱疹病毒属(Cyprinivirus), 基因组大小295 kb, 编码164个ORF, 包括8个重复ORF, 是已知基因组最大的疱疹病毒[3-4]。
在KHVD防治中已经开展了灭活疫苗、弱毒疫苗和DNA疫苗的研究[5-7], 但目前仅有一种CyHV-3商品化疫苗[8]。研究显示, 灭活疫苗较为安全, 但与弱毒疫苗相比, 其免疫保护力较弱, 成本高[9], 而弱毒疫苗又可能出现毒力返强现象, 存在一定安全隐患[6], 因此亟待开发新型疫苗。DNA疫苗利用重组DNA技术将保护性抗原基因插入真核表达载体, 接种到体内进行内源性抗原表达, 诱导机体产生特定的体液和细胞免疫反应[10]。DNA疫苗具有价格低廉、生产方便、便于运输和保存等优点成为新型疫苗的研究热点[11]。在加拿大, 大西洋鲑(Salmo salar)传染性造血器官坏死病毒(infectious hematopoietic necrosis virus, IHNV) DNA疫苗, 成为第一个获准在水产养殖中应用的商业化DNA疫苗[12]。2017年, 大西洋鲑胰腺病毒(salmon pancreas disease virus, SPDV) DNA疫苗被欧洲药品局授权, 可在欧盟内部使用[13]。DNA疫苗在水产养殖中表现出良好的市场前景[14], 并且CyHV-3 DNA疫苗在前期研究中也显示了良好的保护效果[15-18]。
本研究将CyHV-3 ORF148插入pEGFP-N1载体后构建的重组质粒作为DNA疫苗, 通过体内外试验, 分析pORF148的表达情况; DNA疫苗免疫建鲤(Cyprinus carpio var. jian)鱼苗后, 通过ELISA及RT-qPCR方法分别检测特异性抗体水平与免疫相关基因的表达, 分析DNA疫苗诱导的免疫应答情况; 并进一步通过攻毒试验评价DNA疫苗对建鲤的免疫保护效果, 本研究为开发新型CyHV-3 DNA疫苗奠定了基础。
1 材料与方法 1.1 材料pEGFP-ORF148/Top10、pET32a-modORF148/ BL21重组质粒[19]、鼠抗pORF148多克隆抗体[19]、鼠抗鲤多克隆抗体[20]由本实验室前期制备、保存。建鲤脑细胞系(CCB-J)由本实验室建立[21]。CyHV-3毒株由本实验室分离[22]。Lipofectamine 3000试剂盒购自Invitrogen公司。小鼠IgG-SABC- Cy3免疫组化试剂盒购自博士德生物公司。质粒大量制备提取试剂盒购自百泰克公司。无内毒素质粒小提中量试剂盒购自天根公司。RNA提取试剂盒购于OMEGA公司。RT-qPCR试剂盒购于Vazyme公司。DAPI荧光染料购自GENVIEW公司。其他试剂均为国产分析纯。10 g左右的健康建鲤购自成都通威水产苗种有限责任公司, 经PCR检测[23]证明无CyHV-3感染。
1.2 方法 1.2.1 重组质粒pEGFP-ORF148的转染试验根据无内毒素质粒小提试剂盒的说明书分别提取质粒pEGFP-ORF148、pEGFP-N1。将CCB-J细胞(3×105~5×105/mL)接种于24孔板, 放置细胞爬片, 待细胞长至80%~90%融合度时, 按照Lipofectamine 3000说明书将提取的质粒转染至CCB-J细胞。转染48 h后, 4%多聚甲醛固定30 min, 1%BSA 37 ℃封闭1 h, PBST洗涤3次; 加入1 : 100稀释鼠抗CyHV-3 pORF148多克隆抗体, 37 ℃孵育2 h, PBST洗涤3次; 加入1 : 100稀释生物标记羊抗小鼠SABC-Cy3, 37 ℃孵育1 h, PBST洗涤3次; 封片, 激光共聚焦显微镜观察。
1.2.2 重组质粒pEGFP-ORF148的体内表达建鲤鱼苗肌肉注射20 μg重组质粒(pEGFP- ORF148或PBS, n=3), 检测pORF148-EGFP融合蛋白的表达。注射14 d后, 丁香酚(20 mg/L)麻醉处死建鲤, 去除尾柄皮肤, 分离脾脏与注射部位肌肉组织, 冻存在液氮中。上述组织制备5 μm冷冻切片, DAPI染色, 封片, 激光共聚焦显微镜观察。
1.2.3 DNA疫苗免疫根据质粒大提试剂盒的说明书分别提取质粒pEGFP-ORF148、pEGFP-N1。测定浓度后, 采用PBS将质粒稀释至35 ng/μL, –20 ℃保存。取120尾健康建鲤分为3组(n=40), 在尾柄肌肉分别注射pEGFP-ORF148(DNA疫苗组)、pEGFP-N1(空载体对照组)、PBS(空白对照组), 注射剂量为3.5 µg/尾(100 μL)质粒或100 μL/尾PBS, 免疫期间水温控制在20~25 ℃; 免疫3次, 每次间隔2周, 每次免疫2周后每组随机抽取3尾鱼, 丁香酚(20 mg/L)麻醉后尾静脉采集外周血(100 μL/尾), 分离血清, –20 ℃保存。
1.2.4 特异性血清抗体水平检测pET32a-modORF148/BL21诱导表达后纯化重组的CyHV-3 pORF148作为包被抗原, 鼠抗鲤IgM多克隆抗体作为检测抗体, 采用间接ELISA方法, 检测每次免疫后的血清特异性抗体水平[19]。
1.2.5 实时荧光定量PCR (RT-qPCR)检测免疫相关基因表达第3次免疫2周后, 在pEGFP- ORF148组、pEGFP-N1组和PBS组中, 每组随机抽取3尾鱼, 丁香酚(20 mg/L)麻醉处死, 分别取头肾及脾脏, 按照E.Z.N.A. ®Total RNA Kit Ⅱ试剂盒说明书(Omega公司)提取RNA, 样品通过超微量核酸检测仪(德国Thermo)检测纯度和RNA总量。提取的RNA按Hiscript® Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)(Vazyme公司)说明书合成cDNA, 将合成的cDNA稀释10倍, 取3 µL作为模板按ChamQTM Universal SYBR® qPCR Master Mix说明书(Vazyme公司)进行qPCR分析免疫相关基因的表达情况, 选择β-actin作为内参基因, 相关引物序列见表 1。采用2–△△Ct方法计算目的基因相对表达量[24]。
|
|
表 1 免疫相关基因引物序列 Tab.1 The primer sequences of immune-related genes |
上述1.2.3中注射的pEGFP- ORF148组、pEGFP-N1组和PBS组建鲤, 第3次免疫2周后随机选择20尾, 丁香酚(20 mg/L)麻醉, 100 µLCyHV-3毒株(102.0 TCID50/尾)滴鳃攻毒, 冰上静置3 min后放入鱼缸[27]。攻毒实验期间, 水温控制在23~25 ℃, 每天记录各组死亡情况, 攻毒后连续观察21 d, 统计分析各组累积存活率。对3组攻毒死亡的建鲤分别随机取3尾, 提取脑组织DNA作为模板, 按照文献[23]的方法进行CyHV-3检测。
1.2.7 数据统计分析采用SPSS 21.0软件和GraphPad Prism 6.0对数据进行统计分析, 其中抗体水平采用t检验, 攻毒保护绘制Kaplan-Meier生存曲线并采用Log Rank检验, 相对保护率按照以下方法[28]计算: RPS=(1–免疫组死亡率/对照组死亡率)×100%。基因表达量通过单因素方差分析进行多重比较。显著性水平: P < 0.05为显著性差异, P < 0.01为极显著性差异。
2 结果与分析 2.1 重组质粒表达 2.1.1 pEGFP-ORF148融合蛋白的转染试验将pEGFP-ORF148、pEGFP-N1质粒分别转染CCB-J细胞, 转染48 h后, 两组细胞均可见增强型绿色荧光蛋白(EGFP)表达(图 1); 间接免疫荧光结果表明, pORF148在CCB-J细胞中获得表达(图 1)。
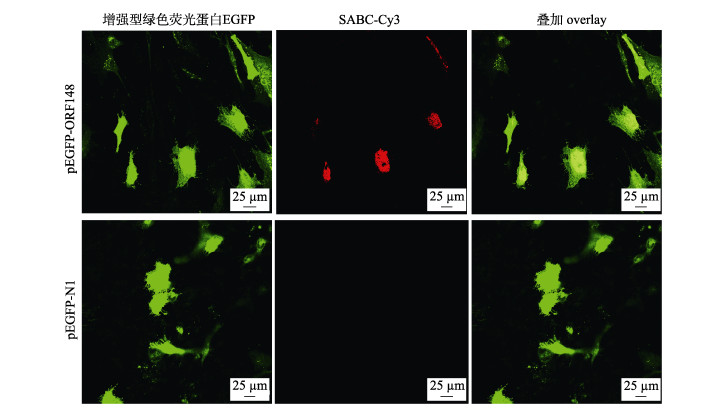
|
图 1 pEGFP-ORF148体外表达 Fig.1 Expression of pEGFP-ORF148 fusion protein in vitro |
为分析pEGFP-ORF148重组质粒在鱼体内表达情况, 肌肉注射20 μg重组质粒, 14 d后取脾脏以及注射部位肌肉, 制备冰冻切片进行显微观察, 结果显示, pEGFP-ORF148组在肌肉和脾脏中均可见绿色荧光信号, PBS组均无绿色荧光(图 2), 表明pEGFP-ORF148融合蛋白可以在鱼体内表达。
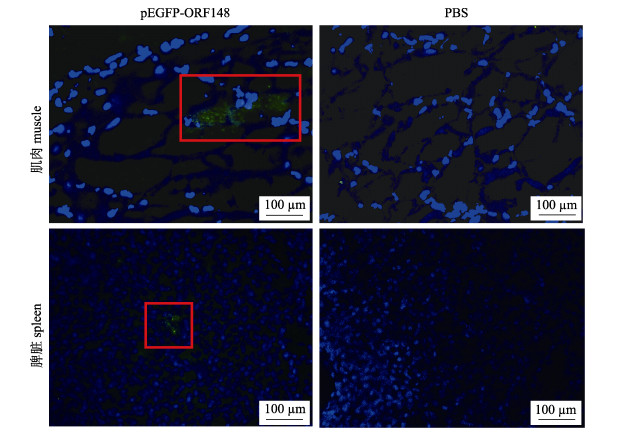
|
图 2 pEGFP-ORF148融合蛋白体内表达 图中红色方框内绿色信号示建鲤组织内表达的pORF148-EGFP融合蛋白. Fig.2 Expression of pEGFP-ORF148 fusion protein in vivo The green signals in the red box indicate the expression of pORF148-EGFP fusion protein in vivo. |
采用间接ELISA方法检测PBS、pEGFP-N1、pEGFP-ORF148注射免疫后的血清特异性IgM水平, 结果显示, pEGFP-ORF148免疫组的血清抗CyHV-3 pORF148抗体水平随着免疫次数增加逐渐升高, 第1次免疫2周后特异性抗体水平显著高于PBS组与pEGFP-N1组(P < 0.05);第2次和第3次免疫2周后, 与PBS组和pEGFP-N1组存在极显著差异(P < 0.01)。pEGFP-N1组的抗CyHV-3 pORF148特异性抗体水平在3次免疫后与PBS组均无显著性差异(P < 0.05) (图 3)。
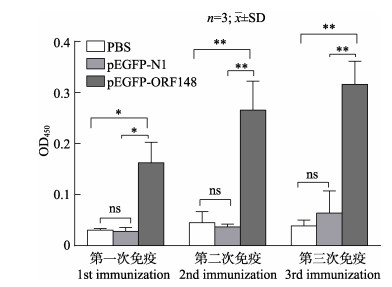
|
图 3 建鲤血清抗CyHV-3 pORF148特异性抗体水平检测 *或**表示显著性差异P < 0.05或P < 0.01. Fig.3 Detection of anti-CyHV-3 pORF148 antibody in serum of Cyprinus carpio var. jian after the immunization with PBS, pEGFP-N1 and pEGFP-ORF148 * and ** indicate the significant difference at P < 0.05 and P < 0.01, respectively. |
通过RT-qPCR分析建鲤在第3次免疫2周后脾脏及肾脏免疫相关基因的表达, 结果显示, 与PBS组相比, 在pEGFP-ORF148疫苗免疫组(DNA疫苗免疫组)建鲤头肾组织中, 天然性免疫基因IFN-a1、CXCa、IL-1β、TNF-α分别极显著地上调表达145.30倍、4.19倍、52.27倍、131倍(P < 0.01), Mx-1和CXCR1分别上调表达4.03倍和3.05倍(P < 0.05); IgM基因极显著地上调表达12.16倍(P < 0.01)。相对于PBS组, DNA疫苗免疫组的脾脏组织中, IFN-a1、CXCa、TNF-α和IgM分别上调22.44倍、4.63倍、6.14倍和4.23倍(P < 0.01), IL-1β上调表达2.56倍(P < 0.05)。值得注意的是pEGFP-N1免疫组的IL-1β在头肾中极显著地上调表达35.94倍(P < 0.01); CXCa在头肾中上调表达3.43倍(P < 0.05), 在脾脏组织中上调表达4.40倍(P < 0.01) (图 4)。
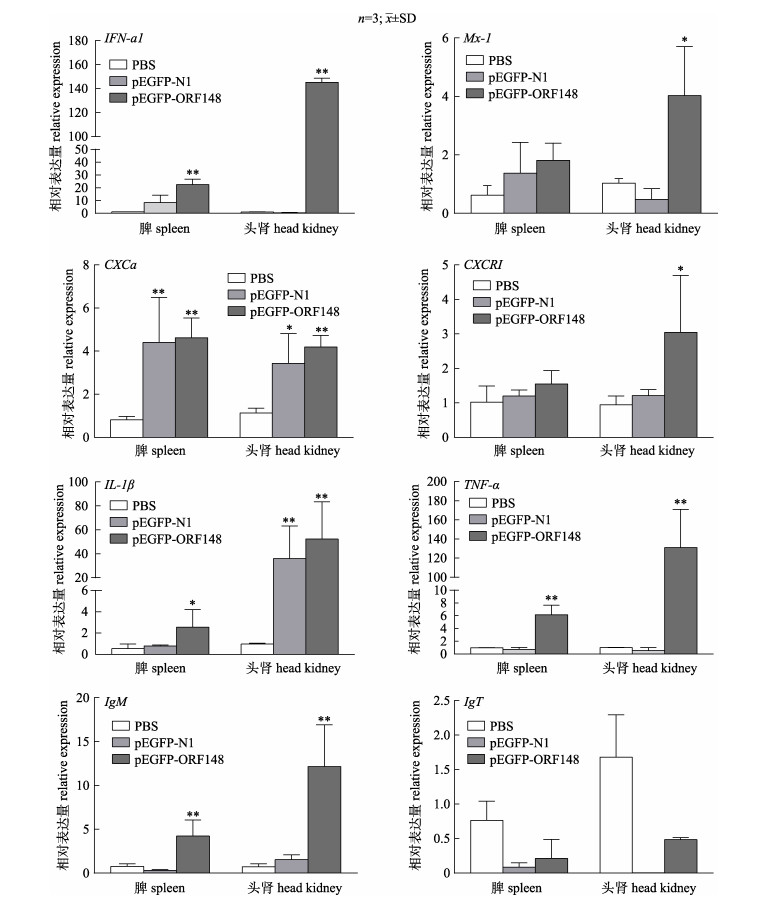
|
图 4 建鲤第三次免疫后相关免疫基因的表达 *或**表示显著性差异P < 0.05或P < 0.01. Fig.4 Immune-related genes expression in the spleen and head kidney of Cyprinus carpio var. jian after the third time immunization with PBS, pEGFP-N1, pEGFP-ORF148 * and ** indicate the significant difference at P < 0.05 and P < 0.01, respectively. |
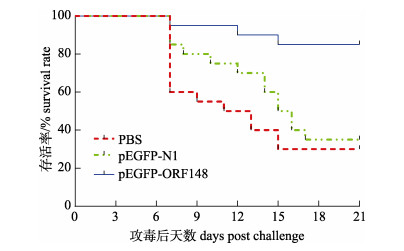
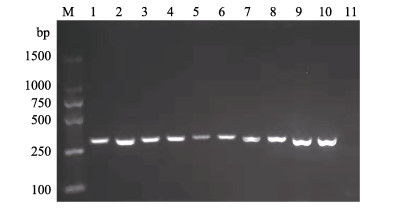
建鲤在第3次免疫2周后进行攻毒实验, 攻毒7 d后建鲤开始死亡, 攻毒15天死亡率趋于稳定, 统计显示PBS组、pEGFP-N1组和pEGFP -ORF148组分别死亡14尾、13尾和3尾, 存活率分别为30%、35%和85% (图 5)。pEGFP-ORF148组建鲤相对PBS组保护率为79%, 相对于pEGFP-N1组保护率为77%。结果显示, 与PBS或pEGFP-N1对照组相比, pEGFP-ORF148免疫后显著提高了攻毒建鲤的存活率(P < 0.01)。对3组死亡的建鲤分别随机取3尾进行CyHV-3检测, 结果均为阳性(图 6)。
|
图 5 CyHV-3攻毒后的免疫建鲤存活率曲线 Fig.5 Survival rates of Cyprinus carpio var. jian immunized with PBS, pEGFP-N1, pEGFP-ORF148 post the CyHV-3 infection |
|
图 6 CyHV-3 PCR检测结果 M: DL 1500 DNA分子质量标准; 1~3: PBS组; 4~6: pEGFP-N1组; 7~9: pEGFP-ORF148组; 10:阳性对照; 11:阴性对照. Fig.6 Detection of CyHV-3 DNA by PCR M: DL 1500 marker; 1-3: PBS; 4-6: pEGFP-N1; 7-9: pEGFP-ORF148; 10: positive control; 11: negative control. |
质谱分析鉴定出的CyHV-3编码蛋白可能有46种[29-30], 包括3种衣壳蛋白、15种囊膜蛋白、2种皮层蛋白和26种未知蛋白[31], 但只有少数的免疫原性已被鉴定[32-33]。CyHV-3至少包含5个基因家族: ORF2、ORF25、ORF72、ORF81和ORF83[33-34]。其中ORF25家族是一个保守家族, 包括ORF 25、65、148和149, 这些基因可能是由一个共同祖先进化而来[34]。ORF148编码糖基化Ⅰ型囊膜蛋白[35], 生物信息分析显示, 该蛋白具有良好的免疫原性[16]。近年来, 两项研究显示使用囊膜蛋白ORF25和ORF81作为DNA疫苗接种可引起鱼体的特异性免疫应答, 显著降低死亡率(< 20%)[15-16]; 后期Embregts等[17]在此基础上研究发现不同的免疫方法和攻毒方式对CyHV- 3 ORF25 DNA疫苗保护效果存在一定影响, 其中选择肌肉注射并通过浸泡攻毒, 相对保护率可达89%; Cui等[18]构建的CyHV-3 ORF81重组疫苗通过胃肠道途径对鲤和锦鲤进行免疫, 相对保护率分别为71%、53%。本研究通过对建鲤肌肉注射接种pEGFP-ORF148疫苗, 攻毒21 d后发现相比于PBS组, ORF148疫苗对的建鲤保护率为79%, 显著提高了攻毒建鲤的存活率。
细胞因子在脊椎动物免疫应答中具有关键作用, 是调节炎症过程中的重要介质[36]。在这些细胞因子中, IL-1β和TNF-α由巨噬细胞产生, 介导对微生物入侵的免疫反应和诱导其他细胞因子表达[27]。本研究结果显示, DNA疫苗免疫后, 在头肾中检测到IL-1β和TNF-α极显著性上调。Pérez-Sánchez等[37]的研究表明, DNA疫苗可以诱导虹鳟(Oncorhynchus mykiss) IL-1β和TNF-α基因的上调表达, 与本研究结果一致。Ⅰ型IFN系统在抗病毒中具有重要作用, 这种抗病毒作用可归因于许多干扰素刺激基因, 如Mx-1等的表达[38], 本研究选择的干扰素基因(AB376666)经进化分析确认为Ⅰ型干扰素: IFN-a1[39]。本研究结果显示, 接种pEGFP-ORF148疫苗的建鲤Mx-1和IFN-a1显著上调表达, 这一结果提示接种DNA疫苗激活了鱼体抗病毒免疫反应。IgM和IgT与鱼类获得性免疫应答相关, IgM是鱼类血清中的主要免疫球蛋白, IgT在黏膜免疫中发挥着重要作用[40]。本研究结果显示, 在接种pEGFP-ORF148疫苗的建鲤头肾和脾脏中IgM极显著上调表达, 而IgT均未上调表达, 一方面, 这可能与取样组织不属于黏膜免疫系统有关; 另一方面, 如何通过优化免疫途径、疫苗递送系统以及免疫佐剂的使用以更好地激活鱼类的黏膜免疫应答, 还有待进一步研究。
值得注意的是, 本研究结果显示在免疫pEGFP-N1疫苗的建鲤头肾组中, IL-1β和CXCa均有显著上调表达。相关研究指出DNA疫苗接种诱导天然免疫应答的机制可能是由于宿主免疫系统识别DNA基序、mRNA转录物或表达的蛋白抗原所致[41]。相关报告表明, 空质粒在保护性免疫应答反应中具有重要作用[14]。非甲基化CpG基序被证明具有病原体相关分子模式(PAMP)的作用, 通过与Toll样受体(TLRs)结合可激活巨噬细胞、树突状细胞、B细胞和刺激Th1细胞[42], 并可间接刺激其增殖或分泌促炎性细胞因子(IL-1β、IL-6、IL-18及TNF-α)和Th1相关的细胞因子(IFN-a1和IL-12)[43]。本研究结果中IL-1β和CXCa在空载体免疫后出现显著上调的现象是否与非甲基化CpG基序作用相关有待下一步研究验证。
| [1] |
Gotesman M, Kattlun J, Bergmann S M, et al. CyHV-3:The third cyprinid herpesvirus[J]. Diseases of Aquatic Organisms, 2013, 105(2): 163-174. DOI:10.3354/dao02614 |
| [2] |
Bergmann S M, Sadowski J, Kiełpiński M, et al. Susceptibility of koi×crucian carp and koi×goldfish hybrids to koi herpesvirus (KHV) and the development of KHV disease (KHVD)[J]. Journal of Fish Diseases, 2010, 33(3): 267-272. DOI:10.1111/j.1365-2761.2009.01127.x |
| [3] |
Han J E, Kim J H, Renault T, et al. Identifying the viral genes encoding envelope glycoproteins for differentiation of cyprinid herpesvirus 3 isolates[J]. Viruses, 2013, 5(2): 568-576. DOI:10.3390/v5020568 |
| [4] |
Bergmann S M, Schütze H, Fischer U, et al. Detection of koi herpesvirus (KHV) genome in apparently healthy fish[J]. Bulletin European Association of Fish Pathologists, 2009, 29(5): 145-152. |
| [5] |
Boutier M, Gao Y, Vancsok C, et al. Identification of an essential virulence gene of cyprinid herpesvirus 3[J]. Antiviral Research, 2017, 145: 60-69. DOI:10.1016/j.antiviral.2017.07.002 |
| [6] |
Boutier M, Ronsmans M, Ouyang P, et al. Rational development of an attenuated recombinant cyprinid herpesvirus 3 vaccine using prokaryotic mutagenesis and in vivo bioluminescent imaging[J]. PLoS Pathogens, 2015, 11(2): e1004690. DOI:10.1371/journal.ppat.1004690 |
| [7] |
Perelberg A, Ronen A, Hutoran M, et al. Protection of cultured Cyprinus carpio against a lethal viral disease by an attenuated virus vaccine[J]. Vaccine, 2005, 23(26): 3396-3403. DOI:10.1016/j.vaccine.2005.01.096 |
| [8] |
Boutier M, Gao Y, Donohoe O, et al. Current knowledge and future prospects of vaccines against cyprinid herpesvirus 3(CyHV-3)[J]. Fish & Shellfish Immunology, 2019, 93: 531-541. |
| [9] |
Ronen A, Perelberg A, Abramowitz J, et al. Efficient vaccine against the virus causing a lethal disease in cultured Cyprinus carpio[J]. Vaccine, 2003, 21(32): 4677-4684. DOI:10.1016/S0264-410X(03)00523-1 |
| [10] |
Wolff J A, Malone R W, Williams P, et al. Direct gene transfer into mouse muscle in vivo[J]. Science, 1990, 247(4949): 1465-1468. DOI:10.1126/science.1690918 |
| [11] |
Heppell J, Davis H L. Application of DNA vaccine technology to aquaculture[J]. Advanced Drug Delivery Reviews, 2000, 43(1): 29-43. DOI:10.1016/S0169-409X(00)00075-2 |
| [12] |
Salonius K, Simard N, Harland R, et al. The road to licensure of a DNA vaccine[J]. Current Opinion in Investigational Drugs, 2007, 8(8): 635-641. |
| [13] |
Dalmo R A. DNA vaccines for fish:Review and perspectives on correlates of protection[J]. Journal of Fish Diseases, 2018, 41(1): 1-9. DOI:10.1111/jfd.12727 |
| [14] |
Collins C, Lorenzen N, Collet B. DNA vaccination for finfish aquaculture[J]. Fish & Shellfish Immunology, 2019, 85: 106-125. |
| [15] |
Zhou J X, Wang H, Li X W, et al. Construction of KHV-CJ ORF25 DNA vaccine and immune challenge test[J]. Journal of Fish Diseases, 2014, 37(4): 319-325. DOI:10.1111/jfd.12105 |
| [16] |
Zhou J X, Xue J D, Wang Q J, et al. Vaccination of plasmid DNA encoding ORF81 gene of CJ strains of KHV provides protection to immunized carp[J]. In Vitro Cellular & Developmental Biology - Animal, 2014, 50(6): 489-495. |
| [17] |
Embregts C W E, Tadmor-Levi R, Veselý T, et al. Intra-muscular and oral vaccination using a Koi herpesvirus ORF25 DNA vaccine does not confer protection in common carp (Cyprinus carpio L.)[J]. Fish & Shellfish Immunology, 2019, 85: 90-98. |
| [18] |
Cui L C, Guan X T, Liu Z M, et al. Recombinant Lactobacillus expressing G protein of spring viremia of carp virus (SVCV) combined with ORF81 protein of koi herpesvirus (KHV):A promising way to induce protective immunity against SVCV and KHV infection in cyprinid fish via oral vaccination[J]. Vaccine, 2015, 33(27): 3092-3099. DOI:10.1016/j.vaccine.2015.05.002 |
| [19] |
Hao L, Liang Z L, Ma J Y, et al. The expression and application of pORF148 recombinant protein: CN108047317A[P]. 2018-05-18. [郝乐, 梁志凌, 马江耀, 等. pORF148重组蛋白及其制备方法和应用: CN108047317A[P]. 2018-05-18.]
|
| [20] |
Ma Y P, Hao L, Liang Z L, et al. Establishment of CyHV-3 pORF65 antibody detection method by indirect carp serum ELISA[J]. South China Fisheries Science, 2018, 14(3): 113-119. [马艳平, 郝乐, 梁志凌, 等. 基于间接ELISA的鲤血清CyHV-3 pORF65抗体检测方法的建立[J]. 南方水产科学, 2018, 14(3): 113-119.] |
| [21] |
Liu Z X, Li Y, Ma Y P, et al. Establishment of carp brain cell line and its application: CN109971710A[P]. 2019-07-05. [刘振兴, 李盈, 马艳平, 等.建鲤脑细胞系及其建立方法与应用: CN109971710A[P]. 2019-07-05.]
|
| [22] |
Liu Z X, Ke H, Ma Y P, et al. First report of occurrences of two cyprinid herpesvirus 3 variants, Ⅰ++ Ⅱ- and Ⅰ++ Ⅱ+Δ, in China[J]. Fish Pathology, 2016, 51(4): 169-175. DOI:10.3147/jsfp.51.169 |
| [23] |
Yuasa K, Sano M, Kurita J, et al. Improvement of a PCR method with the Sph Ⅰ-5 primer set for the detection of koi herpesvirus (KHV)[J]. Fish Pathology, 2005, 40(1): 37-39. DOI:10.3147/jsfp.40.37 |
| [24] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [25] |
Zhang D X, Kang Y H, Chen L, et al. Oral immunization with recombinant Lactobacillus casei expressing OmpAI confers protection against Aeromonas veronii challenge in common carp, Cyprinus carpio[J]. Fish & Shellfish Immunology, 2018, 72: 552-563. |
| [26] |
Forlenza M, Walker P D, de Vries B J, et al. Transcriptional analysis of the common carp (Cyprinus carpio L.) immune response to the fish louse Argulus japonicus Thiele (Crustacea:Branchiura)[J]. Fish & Shellfish Immunology, 2008, 25(1-2): 76-83. |
| [27] |
El-Din M M M. Histopathological studies in experimentally infected koi carp (Cyprinus carpio Koi) with koi herpesvirus in Japan[J]. World Journal of Fish and Marine Sciences, 2011, 3(3): 252-259. |
| [28] |
Yasumoto S, Kuzuya Y, Yasuda M, et al. Oral immunization of common carp with a liposome vaccine fusing koi herpesvirus antigen[J]. Fish Pathology, 2006, 41(4): 141-145. DOI:10.3147/jsfp.41.141 |
| [29] |
Yi Y, Zhang H T, Lee X, et al. Extracellular virion proteins of two Chinese CyHV-3/KHV isolates, and identification of two novel envelope proteins[J]. Virus Research, 2014, 191: 108-116. DOI:10.1016/j.virusres.2014.07.034 |
| [30] |
Michel B, Leroy B, Stalin Raj V, et al. The genome of cyprinid herpesvirus 3 encodes 40 proteins incorporated in mature virions[J]. Journal of General Virology, 2010, 91(2): 452-462. DOI:10.1099/vir.0.015198-0 |
| [31] |
Zheng S C, Wang Q, Li Y Y, et al. Research Advances in cyprinid herpesvirus 3[J]. Chinese Journal of Virology, 2016, 11(1): 108-120. [郑树城, 王庆, 李莹莹, 等. 鲤疱疹病毒3型研究进展[J]. 病毒学报, 2016, 11(1): 108-120.] |
| [32] |
Monaghan S J, Thompson K D, Bron J E, et al. Expression of immunogenic structural proteins of cyprinid herpesvirus 3in vitro assessed using immunofluorescence[J]. Veterinary Research, 2016, 47: 8. DOI:10.1186/s13567-015-0297-6 |
| [33] |
Tu C E, Lu Y P, Hsieh C Y, et al. Production of monoclonal antibody against ORF72 of koi herpesvirus isolated in Taiwan[J]. Folia Microbiologica, 2014, 59(2): 159-165. DOI:10.1007/s12223-013-0261-7 |
| [34] |
Davison A J, Kurobe T, Gatherer D, et al. Comparative genomics of carp herpesviruses[J]. Journal of Virology, 2013, 87(5): 2908-2922. DOI:10.1128/JVI.03206-12 |
| [35] |
Aoki T, Hirono I, Kurokawa K, et al. Genome sequences of three koi herpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide[J]. Journal of Virology, 2007, 81(10): 5058-5065. DOI:10.1128/JVI.00146-07 |
| [36] |
Gomez D, Sunyer J O, Salinas I. The mucosal immune system of fish:The evolution of tolerating commensals while fighting pathogens[J]. Fish & Shellfish Immunology, 2013, 35(6): 1729-1739. |
| [37] |
Pérez-Sánchez T, Balcázar J L, Merrifield D L, et al. Expression of immune-related genes in rainbow trout (Oncorhynchus mykiss) induced by probiotic bacteria during Lactococcus garvieae infection[J]. Fish & Shellfish Immunology, 2011, 31(2): 196-201. |
| [38] |
Robertsen B. The interferon system of teleost fish[J]. Fish & Shellfish Immunology, 2006, 20(2): 172-191. |
| [39] |
Adamek M, Rakus K Ł, Chyb J, et al. Interferon type Ⅰ responses to virus infections in carp cells:In vitro studies on Cyprinid herpesvirus 3 and Rhabdovirus carpio infections[J]. Fish & Shellfish Immunology, 2012, 33(3): 482-493. |
| [40] |
Mikalsen A B, Torgersen J, Aleström P, et al. Protection of Atlantic salmon Salmo salar against infectious pancreatic necrosis after DNA vaccination[J]. Diseases of Aquatic Organisms, 2004, 60: 11-20. DOI:10.3354/dao060011 |
| [41] |
Valero Y, Awad E, Buonocore F, et al. An oral chitosan DNA vaccine against nodavirus improves transcription of cell-mediated cytotoxicity and interferon genes in the European sea bass juveniles gut and survival upon infection[J]. Developmental & Comparative Immunology, 2016, 65: 64-72. |
| [42] |
Tonheim T C, Bøgwald J, Dalmo R A. What happens to the DNA vaccine in fish? A review of current knowledge[J]. Fish & Shellfish Immunology, 2008, 25(1-2): 1-18. |
| [43] |
Klinman D M. CpG DNA as a vaccine adjuvant[J]. Expert Review of Vaccines, 2003, 2(2): 305-315. DOI:10.1586/14760584.2.2.305 |
 2020, Vol. 27
2020, Vol. 27

