2. 青岛海洋科学与技术试点国家实验室, 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology, Qingdao 266071, China
莱州湾是渤海渔业生物重要的产卵场和索饵场, 受过度捕捞、河流陆源污染等人类活动以及区域气候变化的共同影响, 鱼类资源已显著衰退, 主要表现在以下几个方面:资源密度呈下降趋势[1], 特别是春季生殖群体的下降严重影响到资源补充量[2]; 鱼类群落结构出现明显的物种演替现象, 低值、小个体种类比重增加[3], 青鳞小沙丁鱼(Sardinella zunasi)、斑鰶(Konosirus punctatus)、赤鼻棱鳀(Thryssa kammalensis)、鳀(Engraulis japonicus)等小型中上层洄游性鱼类已替代带鱼(Trichiurus haumela)、小黄鱼(Pseudosciaena polyactis)成为群落新优势种[1, 4]; 鱼类物种多样性亦呈现下降趋势[3]。
浮游植物是海洋中主要的初级生产者, 其种类组成、丰度和基础生产力水平的变化将直接通过食物网影响到整个生态系统。莱州湾作为渤海渔业种群的关键栖息地, 其浮游植物群落的演替和长期演变将直接影响到渔业生物的饵料基础及其结构。已有资料显示[5]渤海浮游植物群落在过去50多年来变化显著:角毛藻(Chaetoceros spp.)、圆筛藻(Coscinodiscus spp.)的优势地位逐渐被具槽帕拉藻(Paralia sulcata)、角藻(Tripos, 与Ceratium同物异名)、夜光藻(Noctiluca scintillans)取代; 角毛藻的平均丰度水平较20世纪大幅降低; 群落结构由硅藻主导演替到硅藻、甲藻共同控制, 甲/硅藻比平均水平较20世纪升高了两倍之多。然而, 这种浮游植物优势种组成、甲/硅藻比结构的变动, 对莱州湾海域的渔业生物群落及其资源密度分布带来何种影响尚无定论。本研究通过2011年5—10月在莱州湾海域逐月进行的渔业资源与栖息环境专项调查, 分析了莱州湾浮游植物春、夏、秋三季的群落结构演替特征, 并利用广义可加模型解析了与主要中上层鱼类资源密度之间的关系, 旨在为进一步探讨重要渔业水域关键栖息地的饵料水平和群落结构改变对生态系统食物网结构和渔业生物早期补充过程的影响提供基础资料和参考依据。
1 航次调查与样品分析于2011年春季(5月)、夏季(6月、7月、8月)、秋季(9月、10月)在渤海莱州湾海域(图 1)进行了6个航次的渔业资源与栖息环境专项综合外业调查, 共设置站位18个, 研究内容包括水文环境、浮游植物、游泳动物等。温度、盐度和溶氧等环境参数使用多参数水质监测仪(YSI 6600)进行现场采集。浮游植物使用浅水III型浮游生物网(网口面积0.1 m2, 筛孔对角线长77 μm)自底至表进行垂直拖网, 并加入甲醛水溶液至样品终浓度为5%固定保存, 实验室内取0.5 mL的亚样品置于朱树屏计数框(类似Sedgwick-Rafter计数框), 而后在光学显微镜(Leica Biomed)下进行物种鉴定与丰度统计, 物种分类参考已有标准[6-7]。
|
图 1 莱州湾海域渔业资源与栖息环境调查站位 Fig.1 Sampling sites of fishery resources and habitat environments in the Laizhou Bay |
鱼类群落及其资源密度调查使用专用底拖网(网口高6 m, 网口宽22.6 m, 网口周长109.62 m, 网目为63 mm, 囊网网目20 mm)进行, 拖速为3.0 kn, 现场进行渔获物种类的分类鉴定和基础生物学参数测定, 各站位重量、尾数数据均标准化为单位捕捞努力量渔获量(CPUE, 单位g/h)数据, 即每网拖曳1 h的渔获量。
2 数据处理与模型分析浮游植物群落的物种丰富度、多样性、均匀度和优势度分别采用Margalef指数、Shannon- Weaver指数、Pielou指数和Dufrene-Legendre指数进行计算, 具体公式参考文献[8]。选取青鳞小沙丁鱼、斑鰶、赤鼻棱鳀、鳀4种小型中上层鱼类为研究对象, 利用广义可加模型(GAM)解析其总CPUE分布与环境因子、浮游植物群落结构的关系。GAM模型的一般表达式为:
| $ g({\rm{ \mathsf{ μ} Y}}) = {a_0} + \sum\limits_{i = 1}^n {{f_i}({X_i}) + \varepsilon } $ |
式中, g为连接函数, μY为Y的期望值, a0为截距, fi为解释变量Xi的单变量函数, 通常使用样条平滑估计, 平滑参数通过广义交叉验证(GCV)进行估计, ε为随机变量。
本研究GAM模型的建立和分析使用R软件中mgcv 1.8包实现[9], 响应变量为4种中上层鱼类的总CPUE值, 初始解释变量考虑了时间因素月份(month), 环境要素中的海表温度(sst)、海表盐度、溶氧, 浮游植物群落指标总丰度、硅藻丰度、甲藻丰度、甲/硅藻比(ratio), 优势种丰度指标角毛藻、圆筛藻、几内亚藻(Guinardia)、具槽帕拉藻4硅藻属种及夜光藻、原多甲藻(Protoperidinium)、角藻3甲藻属种。其后通过相关分析(SPSS 20, Pearson)筛选相关性显著的因子, 只保留一种因子用于后续分析, 最终选取了月份、海表温度、总丰度、甲/硅藻比、圆筛藻、具槽帕拉藻、夜光藻、角藻8个指标因子进行分析。GAM终模型的优化过程为:在GCV值最小的单因子预测函数基础上, 逐步添加其他因子, 并选取GCV值最小的二因子预测函数继续添加因子, 以此类推反复优化, 得到GCV值最小的模型即为拟合效果最好的GAM终模型, 预测变量的显著性使用F检验进行评估。
3 结果与分析 3.1 浮游植物物种组成的月变化莱州湾2011年5—10月共记录浮游植物33属78种, 其中硅藻29属67种, 甲藻4属11种。硅藻物种数占到总物种数的平均85.9%, 角毛藻属(Chaetoceros)和圆筛藻属(Coscinodiscus)分别出现了17种和9种; 甲藻物种数占到总物种数的平均14.1%, 角藻属和原多甲藻属分别出现了5种和4种。从优势种组成的月变化来看(表 1), 春夏秋三季的优势属种主要有:辐射圆筛藻(C. radiatus)、星脐圆筛藻(C. asteromphalus)、具槽帕拉藻、夜光藻、牟氏角藻(T. muelleri)、原多甲藻等。在硅藻类群中, 圆筛藻属的物种能够在春夏秋三季皆形成优势, 角毛藻属的物种则只在夏末至秋季形成优势。在甲藻类群中, 除夜光藻能够在春季出现优势外, 其他甲藻物种只在夏秋季出现优势。浮游植物生态类型主要为广温广盐种, 也有暖温种、暖水种和大洋种出现, 比如短孢角毛藻(C. brevis)、萎软几内亚藻(G. flaccida)、印度鼻状藻(Proboscia indica)、笔尖形根管藻(Rhizosolenia styliformis)等暖温类型, 以及洛氏角毛藻(C. lorenzianus)和偏心圆筛藻(C. excentricus)等暖水和大洋类型。
|
|
表 1 莱州湾2011年5—10月浮游植物优势种组成 Tab.1 Dominant phytoplankton taxa during May to October in the Laizhou Bay |
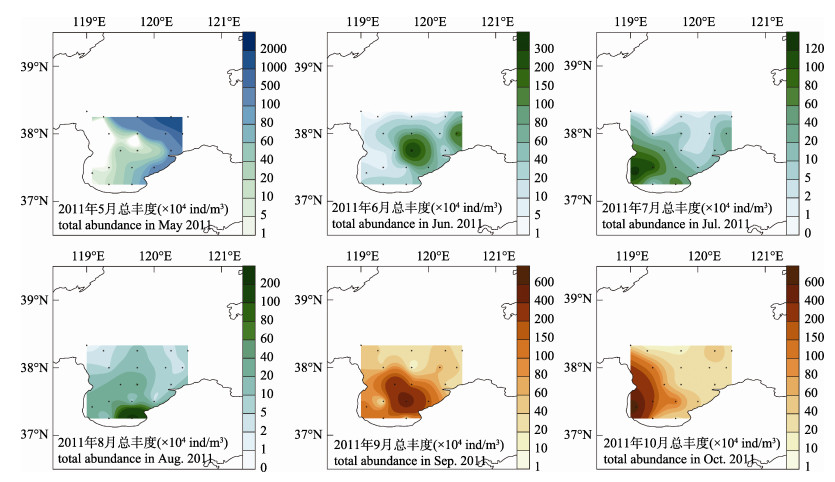
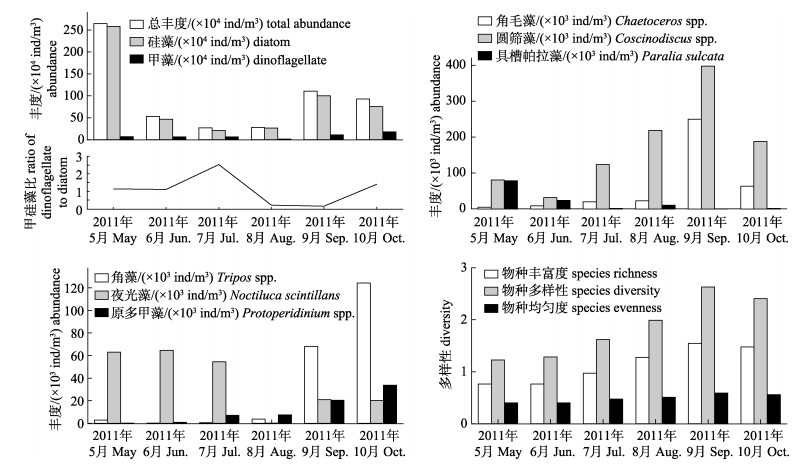
莱州湾5—10月浮游植物总丰度分别变动在(3.3~2033)×104 ind/m3、(1.1~326)×104 ind/m3、(0.74~130)×104 ind/m3、(0.77~271)×104 ind/m3、(7.4~614)×104 ind/m3、(15.1~698)×104 ind/m3, 平均分别为265×104 ind/m3、53.1×104 ind/m3、27.1×104 ind/m3、27.7×104 ind/m3、111×104 ind/m3、92.9×104 ind/m3。总丰度高值区域的分布趋势为:从春末莱州湾东北部水域开始, 到夏初的中部水域和夏中的西南部黄河口水域, 再到夏末的东南部水域, 而后秋初经中南部水域再至秋中的黄河口水域(图 2)。浮游植物总丰度在春、秋季出现两个峰值(图 3), 硅藻丰度的月变化趋势与总丰度较为一致, 5—10月平均分别为258.0×104 ind/m3、46.5×104 ind/m3、20.9×104 ind/m3、26.5×104 ind/m3、99.8×104 ind/m3、75.1×104 ind/m3, 平均占到总丰度的80.8%、76.0%、54.5%、87.8%、86.6%和68.7%。甲藻丰度5—10月平均分别为6.62×104 ind/m3、6.59×104 ind/m3、6.22×104 ind/m3、1.13×104 ind/m3、10.90×104 ind/m3、17.80×104 ind/m3, 秋季9月、10月丰度较高, 较春夏平均增加了1.79倍。从各采样点的甲/硅藻丰度比来看, 莱州湾5—10月的平均水平分别为1.15、1.13、2.54、0.23、0.17和1.42, 最高值出现在夏中7月。
|
图 2 莱州湾2011年5—10月浮游植物总丰度的平面分布 Fig.2 Horizontal distribution of total phytoplankton abundance during May to October in the Laizhou Bay |
从5—10月浮游植物优势种丰度来看(图 3), 角毛藻丰度5—10月平均分别为4.54×103 ind/m3、8.57×103 ind/m3、19.90×103 ind/m3、22.40× 103 ind/m3、250×103 ind/m3、63.70×103 ind/m3, 平均占到总丰度的0.24%、4.29%、5.74%、12.1%、15.7%和13.3%, 丰度最高值出现在秋初9月。圆筛藻丰度5—10月平均分别为80.7×103 ind/m3、31.8×103 ind/m3、124×103 ind/m3、219×103 ind/m3、398×103 ind/m3、188×103 ind/m3, 平均占到总丰度的32.7%、18.7%、34.8%、51.7%、49.3%和32.3%, 丰度最高值亦出现在秋初9月。具槽帕拉藻丰度5—10月平均分别为78.30×103 ind/m3、23.80× 103 ind/m3、1.31×103 ind/m3、10.50×103 ind/m3、0.23×103 ind/m3、1.24×103 ind/m3, 平均占到总丰度的4.14%、9.64%、5.49%、15.9%、0.045%和0.42%, 丰度高值出现在春末5月和夏初6月。角藻丰度月平均分别为2.85×103 ind/m3、0.23× 103 ind/m3、0.57×103 ind/m3、3.76×103 ind/m3、68× 103 ind/m3、124×103 ind/m3, 平均占到总丰度的2.91%、0.21%、0.57%、6.58%、7.83%和18.2%, 丰度最高值出现在秋初9月, 夏末秋初的平均丰度达到了其他月份平均的51.8倍。夜光藻丰度月平均分别为63.10×103 ind/m3、64.70×103 ind/m3、54.50×103 ind/m3、0.12×103 ind/m3、21×103 ind/m3、20.20×103 ind/m3, 平均占到总丰度的18.9%、23.4%、41.6%、0.26%、2.75%和5.29%, 丰度高值出现在春末至夏中。原多甲藻丰度月平均分别为0.20×103 ind/m3、0.93×103 ind/m3、7.13× 103 ind/m3、7.46×103 ind/m3、20.40×103 ind/m3、33.70×103 ind/m3, 平均占到总丰度的0.032%、0.39%、3.36%、5.42%、2.80%和7.77%, 丰度高值出现在夏末秋初。
|
图 3 莱州湾2011年5—10月浮游植物丰度和多样性的月变化 Fig.3 Monthly variations of the phytoplankton abundance and diversity during May to October in the Laizhou Bay |
莱州湾5—10月浮游植物多样性指数出现明显的月变化(图 3), 物种丰富度月平均分别为0.765、0.762、0.973、1.278、1.546和1.477, 夏末至秋中(8—10月)的平均水平较春末至夏中(5—7月)增加了72%。物种多样性月平均分别为1.226、1.282、1.621、1.988、2.629和2.404, 夏末至秋中的平均水平增加了70%。物种均匀度月平均分别为0.404、0.401、0.475、0.51、0.59和0.559, 夏末至秋中的平均水平增加了29.6%。
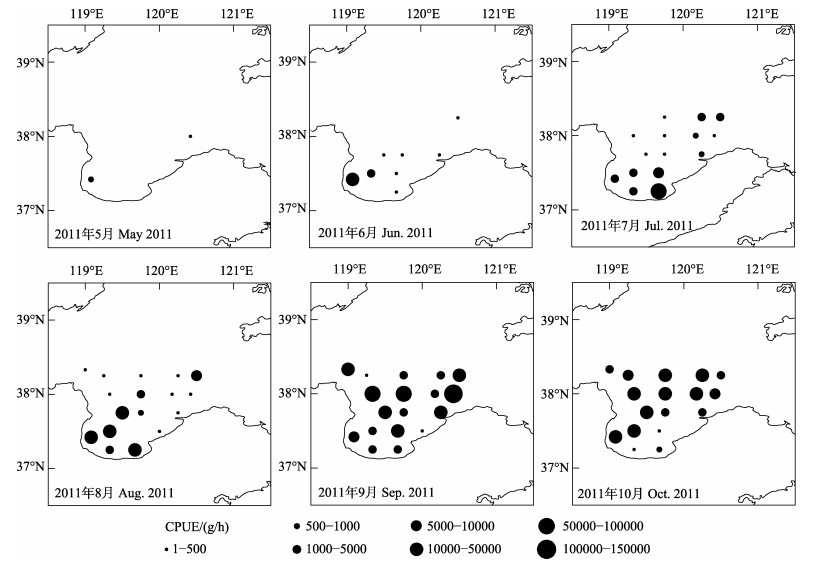
3.4 主要中上层鱼类CPUE的分布莱州湾4种中上层鱼类资源密度的CPUE分布(图 4)月变化明显, 5—10月总CPUE变动在0~140960 g/h之间, 各月平均值分别为57.2 g/h、1635 g/h、5776 g/h、5546 g/h、22962 g/h和9611 g/h。夏季CPUE平均4319 g/h, 较春季平均增加了74.5倍; 秋季CPUE平均16286 g/h, 较夏季平均增加了2.8倍。从总CPUE的季节分布来看, 从春末5月至夏末8月, CPUE在莱州湾呈从东北部渤海海峡至西南部近岸水域分布的趋势, 期间资源密度由湾东北到湾中再到湾西南逐月增加。进入秋季9―10月, 其总CPUE资源密度开始呈现由湾南至湾中再至湾北逐渐增加的分布趋势。
|
图 4 莱州湾2011年5—10月主要中上层鱼类总CPUE的平面分布 Fig.4 Horizontal distribution of total CPUE of major pelagic fishes during May to October in the Laizhou Bay |
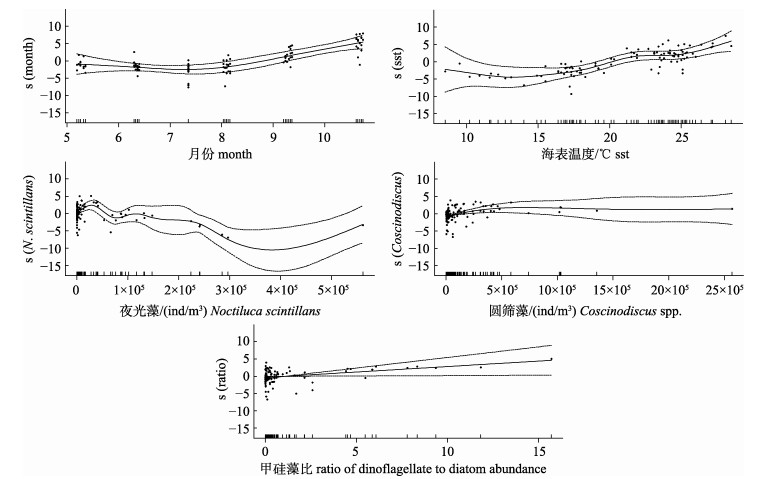
筛选出月份、海表温度、夜光藻、浮游植物总丰度、圆筛藻、具槽帕拉藻、角藻和甲/硅藻比共8个指标作为GAM模型的逐步添加因子进行分析(表 2), 结果显示, 从单因子的偏差解释率来看, 月份和海表温度的偏差解释率分别达到了52.3%和32.1%, 其次为圆筛藻(21.3%)、具槽帕拉藻(17.7%)和角藻(13.1%), 而浮游植物总丰度和夜光藻的单因子偏差解释率相对较小。逐步添加因子对GAM模型进一步优化之后发现, 终模型对4种鱼类CPUE总偏差的累积解释率达到了76.5%, 有较好的预测效果; 终模型中8个因子对CPUE总偏差的解释率由高到低依次为月份(52.3%)、夜光藻(9.3%)、海表温度(8.6%)、浮游植物总丰度(1.9%)、甲/硅藻比(1.8%)、角藻(1.7%)、圆筛藻(0.5%)和具槽帕拉藻(0.4%); 其中, 月份(P < 0.001)、海表温度(P < 0.001)、夜光藻(P < 0.001)、圆筛藻(P < 0.05)、甲/硅藻比(P < 0.05) 5个预测变量经F检验后皆达到显著水平以上。
|
|
表 2 GAM分析过程参数及终模型参数 Tab.2 Parameters in the GAM setup and in the final model |
GAM终模型中预测变量的平滑函数图(图 5)显示, 变量月份和海表温度对4种中上层鱼类资源密度呈明显的正向作用; 夜光藻丰度在3× 105 ind/m3以内表现出了极显著的负相关性; 圆筛藻丰度在5×105 ind/m3以内表现出了显著的正向相关; 甲/硅藻丰度比也对总CPUE的分布表现出了显著积极的影响。
|
图 5 GAM终模型预测变量的平滑函数图 Fig.5 Smooth functions of predictor variables in the final GAM model |
对莱州湾浮游植物群落的生态学研究最早始于20世纪50年代开展的全国海洋综合调查, 据1958—1959年的调查资料记载[10]:莱州湾春、夏、秋、冬四季的浮游植物丰度高值分别为硅藻类群中的尖刺拟菱形藻(Pseudo-nitzschia pungens)、柔弱角毛藻(C. debilis)、圆筛藻、菱形藻(Nitzschia spp.)所决定, 甲藻(角藻等)的密集区主要形成于夏秋季; 浮游植物生态类型主要为广温广盐近岸种, 常见冰河拟星杆藻(Asterionellopsis glacialis)、布氏双尾藻(Ditylum brightwellii)、中肋骨条藻(Skeletonema costatum)、菱形海线藻(Thalassionema nitzschioides), 以及角毛藻、圆筛藻和角藻等优势属种。具槽帕拉藻在低水温期出现, 透明幅杆藻(Bacteriastrum hyalinum)则是高水温期的代表种, 夜光藻在莱州湾的春秋季易出现丰度的密集分布区[10]。本研究莱州湾2011年5—10月物种组成的变动与历史资料的季节规律较为一致, 从硅藻来看, 春末5月水温较低时具槽帕拉藻丰度很高, 进入6月其丰度逐渐降低, 此时圆筛藻的丰度开始升高, 并一直持续到秋初9月达到峰值, 同时出现角毛藻的丰度峰值; 从甲藻来看, 春末至夏中主要为夜光藻控制, 7月原多甲藻开始出现优势, 进入8月夜光藻丰度降至最低, 此时角藻逐渐形成优势, 并与原多甲藻共同维持丰度峰值持续到秋中10月, 同时伴有夜光藻丰度的秋季次峰值。
莱州湾西南部水域浮游植物的分布主要受到黄河、小清河、潍河等径流入海, 及其淡水、泥沙、陆源物质输送的影响, 东部水域主要受到近岸海水养殖等因素的影响, 东北部水域则主要是受到渤海中部至渤海海峡水动力条件的影响。因此, 莱州湾浮游植物分布的季节性和斑块性明显, 丰度高值多出现在夏末8月, 且主要分布在莱州湾东部水域[11-12]。本研究亦发现夏中7月浮游植物丰度高值区出现在西南部沿岸水域, 8月密集分布在东南部水域, 这与夏季黄河径流增强和调水调沙有直接的关系, 夏季黄河冲淡水舌向东北方向扩展, 有一部分沿岸南下[10], 尽管对莱州湾营养盐水平的提升有积极作用, 但是泥沙引起的光限制也对浮游植物的生长产生不利影响, 因此夏季7—8月从河口至东北部水域浮游植物的丰度并不高。秋季黄河入海径流集中于湾内[10], 其营养输入(硅酸盐[13]等)对维持秋季湾内浮游植物的丰度高值(圆筛藻、角毛藻等)有着重要的作用。春季在莱州湾的东北水域, 表层有一股高盐外海水自湾的东北部楔入[10], 其形成的锋面效应是引起浮游植物丰度激增的原因之一, 本研究发现5月莱州湾东北部水域出现浮游植物丰度的高值分布区, 主要由地中海指管藻(Dactyliosolen mediterraneus)引起, 这与该水域春季水动力条件的改变有着密切的联系, 该种也曾在福建同安湾的2011年6月记录到并导致赤潮发生[14]。与历史资料比较后发现(表 3), 尽管莱州湾浮游植物丰度存在年代际变动和季节波动, 从整个莱州湾长期来看, 其丰度自1982年之后还是出现了下降的趋势, 2011年的调查结果分别较2002年、1992年和1982年平均下降了83.4%、23.3%和89.9%;近岸和养殖水域的丰度高值主要出现在夏末秋初8—9月, 丰度波动的时空差异皆较大, 养殖区同期小范围的差异可达近4.93倍[15], 相同区域不同季节差异可达282倍[16]。
|
|
表 3 莱州湾浮游植物丰度变动的历史资料比较 Tab.3 Variation on the phytoplankton abundance in comparison with previous literatures in the Laizhou Bay |
莱州湾是黄渤海渔业生物的主要产卵场、栖息地和索饵场[18], 被誉为渤海的“母亲湾”, 在近海环境变化和捕捞压力的共同影响下, 自20世纪80年代以来, 带鱼、小黄鱼等大型底层鱼类在群落中的优势地位逐渐被鳀、赤鼻棱鳀、斑鰶、青鳞小沙丁鱼等小型中上层洄游性鱼类代替[1, 4, 18]。春夏产卵季的研究也表明:莱州湾及黄河口水域春季的优势鱼卵为鳀、赤鼻棱鳀、斑鰶等[19-20]; 自1982年以后莱州湾鱼卵、仔稚鱼个体资源数量下降趋势明显[21]。本研究选取了春末5月至秋中10月, 分析该段时间浮游植物群落演替与资源密度变动的关系, 涵盖了春季产卵生殖群体和秋季渔汛捕捞群体, 且处在越冬洄游之前; 4种主要中上层鱼类在5—10月的CPUE之和占到所有鱼类总CPUE的64.7%, 且在其生活史的不同阶段, 皆存在对浮游植物饵料基础的需求; 浮游植物在春末至秋中时间段群落结构演替明显。利用广义可加模型解析浮游植物丰度、优势种、甲/硅藻比等群落结构指标的变动与资源密度分布的关系, 对于进一步探讨渔业种群关键栖息地早期补充和食物网过程的影响因素, 可从浮游饵料基础变动的角度提供数据资料和线索。
海洋鱼类在其生活史的不同阶段对食物的选择性也不同, 浮游植物在其特定的生长时期可作为重要的基础饵料。研究表明, 秘鲁鳀(E. ringens)仔鱼[22]至成体皆可滤食浮游植物, 圆筛藻在成体食物中的比例高达54%[23], 此外还有海链藻(Thalassiosira)、原多甲藻等[23]; 鳀则主要是在成体阶段滤食浮游植物, 包括原多甲藻、牟氏角藻、梭形角藻(T. fusus)等[24]; 在北黄海圆筛藻和具槽帕拉藻皆是鳀幼鱼至成鱼的主要饵料[25]; 斑鰶摄食的浮游植物饵料主要有圆筛藻、舟形藻(Navicula spp.)、根管藻等[26]; 远东拟沙丁鱼(Sardinops melanostictus)除了圆筛藻、海链藻、舟形藻等硅藻饵料, 也摄食牟氏角藻、鳍藻(Dinophysis)等甲藻[27]。已有研究显示莱州湾浮游植物丰度自1982年之后呈逐渐下降的趋势[11], 角毛藻丰度的平均水平在渤海和莱州湾分别较20世纪下降了76.6%和87.2%[5]。本研究同样发现角毛藻在莱州湾的优势地位显著降低, 5—10月丰度平均仅占到浮游植物总丰度的8.9%, 且仅在9月出现一次丰度最大值。但是, 圆筛藻在莱州湾的优势地位仍能保持, 调查期间各月份皆为优势种, 特别是在夏中7月至秋中10月时间段, 其丰度平均占到浮游植物总丰度的36.7%, 是角毛藻的4倍之多。因此, 圆筛藻是莱州湾渔业生物重要的浮游植物饵料基础, 其丰度变动也将给特定渔业生物种群的资源密度带来影响, 比如鳀、赤鼻棱鳀、斑鰶、青鳞小沙丁鱼等小型中上层鱼类以及中国对虾等甲壳类。本研究GAM模型的分析也印证了这一点, 圆筛藻对莱州湾4种中上层鱼类的总CPUE分布有着积极的作用。夜光藻被认为是全球海洋赤潮的肇事原因种之一, 尽管不是有毒甲藻, 其危害主要是暴发性增殖后死亡分解过程大量消耗水体的溶氧, 使水体呈现缺氧状态, 并且黏附在鱼鳃上导致鱼类窒息死亡, 破坏水体生态平衡的同时对养殖业和渔业造成巨大损失[28]。本研究发现莱州湾夜光藻的分布与小型中上层鱼类的总资源密度之间存在极显著的负相关性, 表明夜光藻的大量繁殖对浮游植物饵料基础构成负面的影响, 不利于渔业生物的资源补充及其食物网过程, 已有鱼类胃含物食物组成分析的研究亦未见夜光藻可作为主要食物的报道。然而, 尽管从春季开始夜光藻出现丰度高值, 但是进入夏中, 原多甲藻、角藻等甲藻类群的丰度水平开始升高, 其7―10月的平均丰度分别占到浮游植物总丰度的4.84%和8.30%, 这些甲藻物种皆是渔业生物不同阶段食物的组成部分。因此, 甲藻在浮游植物总丰度中所占比例的提升对渔业种群资源补充和食物网过程产生何种影响, 与甲藻的优势种组成有直接的关系, 此外, 饵料的粒径是否适口, 水华的时机与鱼类的生活史过程是否严格匹配, 都会影响到渔业生物的资源补充。本研究发现甲/硅藻比的升高对资源密度的分布有正向的积极作用, 表明莱州湾浮游植物群落长期演变后的基础饵料结构和水平, 对维持鱼类群落结构及其资源量的现状具有关联性和可持续性, 更长期的浮游植物饵料基础与渔业种群资源密度关系的探讨, 还需要更多资料的积累来补充和完善。
| [1] |
Jin X S, Deng J Y. Variations in community structure of fishery resources and biodiversity in the Laizhou Bay, Shandong[J]. Biodiversity Science, 2000, 8(1): 65-72. [金显仕, 邓景耀. 莱州湾渔业资源群落结构和生物多样性的变化[J]. 生物多样性, 2000, 8(1): 65-72. DOI:10.3321/j.issn:1005-0094.2000.01.009] |
| [2] |
Jin X S, Deng J Y. Yearly variations of fishery resources and biodiversity in the Laizhou Bay[J]. Marine Fisheries Research, 1999, 20(1): 6-12. [金显仕, 邓景耀. 莱州湾春季渔业资源及生物多样性的年间变化[J]. 海洋水产研究, 1999, 20(1): 6-12.] |
| [3] |
Yang Y Y, Li Z Y, Wu Q, et al. Interannual variations in community structure and species diversity of fishery resources in the Laizhou Bay[J]. Progress in Fishery Sciences, 2016, 37(1): 22-29. [杨尧尧, 李忠义, 吴强, 等. 莱州湾渔业资源群落结构和多样性的年际变化[J]. 渔业科学进展, 2016, 37(1): 22-29.] |
| [4] |
Li F, Xu B Q, Lü Z B, et al. Ecological niche of dominant species of fish assemblages in Laizhou Bay, China[J]. Acta Ecologica Sinica, 2018, 38(14): 5195-5205. [李凡, 徐炳庆, 吕振波, 等. 莱州湾鱼类群落优势种生态位[J]. 生态学报, 2018, 38(14): 5195-5205.] |
| [5] |
Luan Q S, Kang Y D, Wang J. Long-term changes in the phytoplankton community in the Bohai Sea (1959-2015)[J]. Progress in Fishery Sciences, 2018, 39(4): 9-18. [栾青杉, 康元德, 王俊. 渤海浮游植物群落的长期变化(1959~2015)[J]. 渔业科学进展, 2018, 39(4): 9-18.] |
| [6] |
Jin D X, Chen J H, Huang K G. Planktonic Diatoms in China Seas[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1965: 1-230. [金德祥, 陈金环, 黄凯歌. 中国海洋浮游硅藻类[M]. 上海: 上海科学技术出版社, 1965: 1-230.]
|
| [7] |
Tomas C R. Identifying Marine Phytoplankton[M]. San Diego: Academic Press, 1997.
|
| [8] |
Zhang X, Luan Q S, Sun J Q, et al. Annual variation in phytoplankton community and its relationship with ambient environmental factors in adjacent waters of Zhangzi Island[J]. Journal of Dalian Ocean University, 2016, 31(3): 315-323. [张雪, 栾青杉, 孙坚强, 等. 獐子岛海域浮游植物群落周年变化及其与环境因子的关系[J]. 大连海洋大学学报, 2016, 31(3): 315-323.] |
| [9] |
Wood S N. Generalized Additive Models:An Introduction with R[M]. 2nd edition. Boca Raton: CRC Press, 2017.
|
| [10] |
Compilation Committee of the China Bays & Estuaries. China Bays & Estuaries (3rd fascicule)[M]. Beijing: China Ocean Press, 1993. [中国海湾志编纂委员会. 中国海湾志(第三分册)[M]. 北京: 海洋出版社, 1993.]
|
| [11] |
Wang J. Study on population dynamics of phytoplankton in Laizhou Bay[J]. Marine Fisheries Research, 2000, 21(3): 33-38. [王俊. 莱州湾浮游植物种群动态研究[J]. 海洋水产研究, 2000, 21(3): 33-38.] |
| [12] |
Li G L, Chen B J, Cui Y, et al. Ecological characteristics of phytoplankton in the Laizhou Bay[J]. Journal of Fishery Sciences of China, 2006, 13(2): 292-299. [李广楼, 陈碧鹃, 崔毅, 等. 莱州湾浮游植物的生态特征[J]. 中国水产科学, 2006, 13(2): 292-299. DOI:10.3321/j.issn:1005-8737.2006.02.020] |
| [13] |
Sun H H, Liu X H, Sun X Y, et al. Temporal and spatial variations of phytoplankton community and environmental factors in Laizhou Bay[J]. Marine Environmental Science, 2017, 36(5): 662-669. [孙慧慧, 刘西汉, 孙西艳, 等. 莱州湾浮游植物群落结构与环境因子的时空变化特征研究[J]. 海洋环境科学, 2017, 36(5): 662-669.] |
| [14] |
Cai J D, Jia G F, Wang X, et al. Impacts of red tides on population stability of alga species related to red tides[J]. Fisheries Science, 2011, 30(2): 87-90. [蔡建堤, 贾光风, 王旭, 等. 赤潮对引发赤潮藻类的种群稳定性影响的研究[J]. 水产科学, 2011, 30(2): 87-90. DOI:10.3969/j.issn.1003-1111.2011.02.006] |
| [15] |
Chen B J, Chen J F, Cui Y, et al. The ecological characteristics of phytoplankton in the Eastern marineculture area of Laizhou Bay[J]. Marine Fisheries Research, 2001, 22(3): 64-70. [陈碧鹃, 陈聚法, 崔毅, 等. 莱州湾东部养殖区浮游植物的生态特征[J]. 海洋水产研究, 2001, 22(3): 64-70.] |
| [16] |
Ning X X, Ji L, Wang G, et al. Phytoplankton community in the nearshore waters of Laizhou Bay in 2009[J]. Transactions of Oceanology and Limnology, 2011(3): 97-104. [宁璇璇, 纪灵, 王刚, 等. 2009年莱州湾近岸海域浮游植物群落的结构特征[J]. 海洋湖沼通报, 2011(3): 97-104. DOI:10.3969/j.issn.1003-6482.2011.03.015] |
| [17] |
Zhang X J, Zhao S. Relationship between phytoplankton community and environmental factors in western Laizhou Bay[J]. Journal of Dalian Ocean University, 2018, 33(4): 532-538. [张晓举, 赵升. 莱州湾西部浮游植物群落与环境因子关系的研究[J]. 大连海洋大学学报, 2018, 33(4): 532-538.] |
| [18] |
Deng J Y, Jin X S. Study on fishery biodiversity and its conservation in Laizhou Bay and Yellow River estuary[J]. Zoological Research, 2000, 21(1): 76-82. [邓景耀, 金显仕. 莱州湾及黄河口水域渔业生物多样性及其保护研究[J]. 动物学研究, 2000, 21(1): 76-82. DOI:10.3321/j.issn:0254-5853.2000.01.015] |
| [19] |
Gao Y J, Lü Z B, Yang Y Y, et al. Structure and species diversity of ichthyoplankton in spring in Laizhou Bay[J]. Acta Ecologica Sinica, 2016, 36(20): 6565-6573. [高彦洁, 吕振波, 杨艳艳, 等. 莱州湾春季鱼卵仔稚鱼群落结构和物种多样性[J]. 生态学报, 2016, 36(20): 6565-6573.] |
| [20] |
Qin X, Zhang C L, Xiao H H, et al. Composition and distribution of fish eggs and larvae in Yellow River Estuary[J]. Periodical of Ocean University of China, 2017, 47(7): 46-55. [秦雪, 张崇良, 肖欢欢, 等. 黄河口水域春、夏季鱼卵、仔稚鱼种类组成和数量分布[J]. 中国海洋大学学报(自然科学版), 2017, 47(7): 46-55.] |
| [21] |
Wang A Y, Wan R J, Jin X S. Decadal variations of ichthyoplankton biodiversity in spring in Laizhou Bay of the Bohai Sea[J]. Progress in Fishery Sciences, 2010, 31(1): 19-24. [王爱勇, 万瑞景, 金显仕. 渤海莱州湾春季鱼卵、仔稚鱼生物多样性的年代际变化[J]. 渔业科学进展, 2010, 31(1): 19-24. DOI:10.3969/j.issn.1000-7075.2010.01.004] |
| [22] |
Zhu C D. Aspects on the first-feeding stage and foods of fish larvae[J]. Acta Hydrobiologica Sinica, 1986, 10(1): 86-95. [朱成德. 仔鱼的开口摄食期及其饵料综述[J]. 水生生物学报, 1986, 10(1): 86-95.] |
| [23] |
Espinoza P, Bertrand A. Revisiting Peruvian anchovy (Engraulis ringens) trophodynamics provides a new vision of the Humboldt Current system[J]. Progress in Oceanography, 2008, 79(2-4): 215-227. DOI:10.1016/j.pocean.2008.10.022 |
| [24] |
Meng T X. Studies on the feeding of anchovy (Engraulis japonnicus) post larva in the spawning ground in the Southern waters of Shandong peninsula[J]. Marine Fisheries Research, 2001, 22(2): 21-25. [孟田湘. 山东半岛南部鳀鱼产卵场鳀鱼仔、稚鱼摄食的研究[J]. 海洋水产研究, 2001, 22(2): 21-25.] |
| [25] |
Chen J K. Studies on the feeding of anchovy (Engraulis japonnicus) in the Northern Yellow Sea[C]//Cruise Report of Liaoning Marine Fisheries Research Institute, 1978, 43: 1-11. [陈介康.黄海北部日本鳀鱼食性的研究[C]//辽宁省海洋水产研究所调查报告, 1978, 43: 1-11.]
|
| [26] |
Zhao C Y. China Marine Fishery Resources-China Fishery Resources Survey and Province (6th)[M]. Hangzhou: Zhejiang Scientific & Technical Publishers, 1990. [赵传絪. 中国海洋渔业资源——中国渔业资源调查和区划之六[M]. 杭州: 浙江科技出版社, 1990.]
|
| [27] |
Qian S Q, Hu Y Z. A study on the feeding behaviour of Japanese pilchard, Sardinops melanosticta, in the off Coast of the East China Sea[J]. Marine Fisheries, 1993, 15(4): 151-154. [钱世勤, 胡雅竹. 东海外海远东拟沙丁鱼摄食习性的研究[J]. 海洋渔业, 1993, 15(4): 151-154.] |
| [28] |
Huang W J, Qi Y Z. Environmental influence on growth of Noctiluca scientillans in Dapeng Bay, north of South China Sea[J]. Marine Science Bulletin, 1993, 12(2): 17-22. [黄伟建, 齐雨藻. 大鹏湾海水理化因子对夜光藻生长影响的因子分析[J]. 海洋通报, 1993, 12(2): 17-22.] |
 2020, Vol. 27
2020, Vol. 27
