2. 青岛海洋科学与技术试点国家实验室, 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266235;
3. 中国水产科学研究院黄海水产研究所, 山东省渔业资源与生态环境重点实验室, 山东 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology(Qingdao), Qingdao 266235, China;
3. Shandong Provincial Key Laboratory for Fishery Resources and Eco-environment, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
过度捕捞、水体污染和工业化开发等人类活动已导致世界上多数国家海洋渔业资源出现严重衰退现象, 增殖放流是近海渔业资源短期恢复的有力措施。据不完全统计, 2011—2016年, 20个国家共放流了187个品种[1]。截至2018年, 世界沿海80多个国家开展了约200个物种的增殖放流, 但绝大多数并没有达到预期效果[1]。Lee等[2]综述了2018年来全球160多个人工鱼礁的研究概况, 发现人工鱼礁的建设目的已从增殖渔业转移到恢复海洋生态系统。
国外诸多专家提出海洋牧场建设的终极目标是恢复生态系统, 通过投放人工鱼礁和增殖放流来重组生态系统食物网结构和功能以达到恢复生态系统的目的[3-10]。Ziemann[3]呼吁应重视衰退渔业的自然补充; Loneragan等[7]认为澳大利亚不同海域的海洋牧场应有不同的增养殖策略, 有的重在种群恢复, 有的应重视生态系统建设; 韩国于2014年将单纯的资源增殖调整为恢复生态系统的增殖放流[11]。日本作为栽培渔业发展最成熟和完善的国家, 于2013年否定了其自1963年开始已实施50年的“栽培渔业”研究成效, 目前已将过去“一代回收型”的栽培渔业理念改为“资源造成型”[12]; 并于2015年开始在西濑户内海实施Satoumi计划, 即在人工鱼礁区增殖放流洄游范围大、跨海域分布的苗种, 通过放流种的溢出效应建立与周边水域自然营养流通道以达到恢复生态系统的目的[8]。日本Tanaka等[8]提出海洋牧场的人工鱼礁与增殖放流不仅要恢复商品渔业资源种类, 更要增强牧场初级生产力和各种群补充量, 以恢复牧场及其周边海域的生态系统。国内目前在增殖放流如何增强与恢复放流海域生态系统结构与功能方面的研究相对较少。
数量和生物量优势度曲线(abundance and biomass curves, ABC), 通常用来监测干扰对底栖无脊椎动物群落的影响[13]。ABC曲线法具有生态学中r选择和k选择的理论基础, 可用来比较分析不同捕捞历史状况下和不同干扰情况下渔业资源群落的反应, 因此可作为一种基于生态系统渔业管理的基本方法。应用ABC曲线法分析人为干扰对各种渔业资源群落的影响, 可确定生物群落受干扰的程度。近年来, 随着分析手段的不断加强, ABC曲线法在鱼类及整个渔业资源研究中的应用越来越多[14-15]。本文通过对比分析2013—2015年每年春季(5月)和夏季(8月)崂山湾鱼类与游泳生物群落结构稳定性的时间格局, 尝试从渔业资源群落结构稳定性的角度, 通过放流种类是否具有稳定放流海域渔业资源群落结构的功能来筛选增殖放流种类, 为放流种类的筛选提供另一依据, 为重建自然生态系统的研究提供基本科学依据。
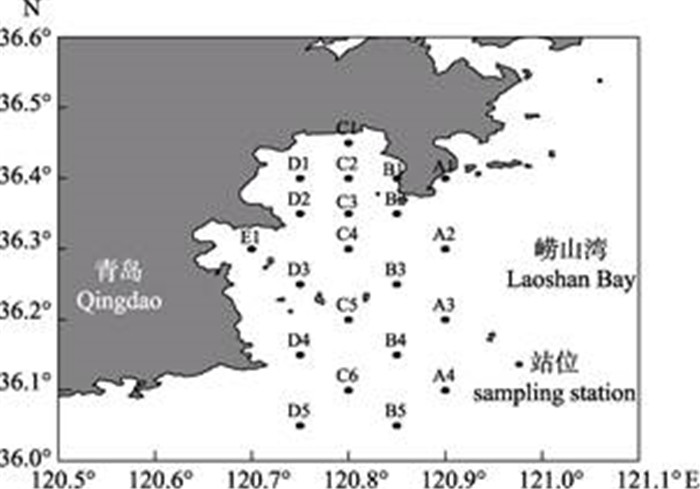
1 材料与方法 1.1 数据来源数据来源于2013―2015年每年春季和夏季的渔业拖网调查, 调查区域为36°N~36.6°N、120.6°E~ 121°E (图 1)。渔业资源评估调查租用14.7 kW单拖渔船, 采用底拖网, 网口宽3.75 m, 高度1.65 m, 囊网网目13 mm。每站拖曳1 h, 拖速3.0节。所有样品的处理、分析鉴定和资料整理和数据处理均按《海洋监测规范》(GB 17378-2007)和《海洋调查规范》(GB/T 12763-2007)规定的方法进行。
1.2 分析方法渔业资源量的估算采用扫海面积法。应用数量与生物量累积曲线法(abundance biomass comparison curves, ABC曲线)及W统计值判断渔业资源群落受干扰程度[11]。计算公式如下:
| $ D = C/\left( {q \times A} \right) $ | (1) |
| $ W = \sum\limits_{i = 1}^s {\frac{{{B_i} - {A_i}}}{{50(s - 1)}}} $ | (2) |
|
图 1 崂山湾调查区域及站位设置 Fig.1 The sampling station in Laoshan Bay |
式中, C为每小时取样面积内的渔获量, q为网具捕获率(底层鱼类q取0.5, 中上层鱼类q取0.3), A为网具每小时扫海面积(因本文进行年际间的比较, 进行D计算时没有将A计算在内, D最后单位为kg/h或ind/h)。公式(2)中, Bi和Ai为ABC曲线中种类序号对应的生物量和数量的累积百分比, s为出现物种数。数量与生物量累积曲线X轴为物种序号, Y轴为物种生物量或数量的累积百分比。生物量优势度曲线在数量优势度曲线之上表示群落结构比较稳定, 受干扰少, 此时W为正; 生物量优势度曲线与数量优势度曲线相交表示群落相对稳定, 受一定程度的干扰; 生物量优势度曲线位于数量优势度曲线之下, 表示群落处于严重干扰状态, 此时W为负。基于ABC曲线, 通过对比分析稳定群落结构稳定性的种类来甄选增殖放流种类, 通常在群落结构受干扰时未出现的种类, 而在群落结构稳定时出现的种类多为群落结构稳定种。
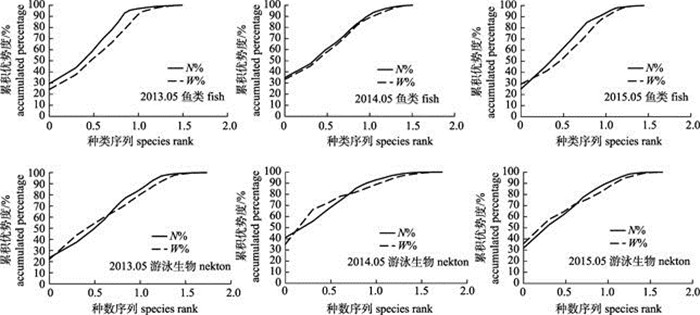
2 结果与分析 2.1 春季崂山湾鱼类与游泳生物群落结构ABC曲线图 2为2013—2015年3个年度春季崂山湾鱼类与游泳生物数量与生物量的ABC曲线图。
|
图 2 2013—2015年春季崂山湾鱼类与游泳生物群落结构的数量生物量曲线 Fig.2 The spring ABC curves of fish and nekton community structure in Laoshan Bay during 2013–2015 |
从图 2可知, 2013—2015年3个年度崂山湾春季鱼类群落结构处于扰动状态, 3个年度的ABC曲线W统计值分别为‒0.52、‒0.16和‒0.43。2013年和2014年鱼类群落的数量优势度曲线位于生物量优势度曲线之上, 但2014年较2013年鱼类群落结构稳定性有所增强; 2015年鱼类群落的生物量优势度曲线开始位于数量优势度曲线之上, 随着鱼类种类序列的增加, 生物量优势度曲线迅速位于数量优势度曲线之下。较2013年, 2014年崂山湾鱼类中个体相对较大的皮氏叫姑鱼(Johnius belengerii)、短吻红舌鳎(Cynoglossus joyneri)、斑鰶(Konosirus punctatus)、黄鮟鱇(Lophius litulon)和银鲳(Pampus argenteus)等生物量比例有所增加, 小个体虾虎鱼的生物量比例大幅减少。短吻红舌鳎生物量比例在2015年春季达到最高值, 致使其生物量优势度曲线位于数量优势度曲线之上, 但矛尾虾虎鱼(Chaeturichthys stigmatias)、中华栉孔虾虎鱼(Ctenotrypauchen chinensis)和红狼牙虾虎鱼(Odontamblyopus rubicundus)等小个体生物数量比例的大幅增加, 致使鱼类的数量优势度曲线在第2种鱼之后就位于生物量优势度曲线之上。由此可知, 崂山湾春季鱼类种群结构变化较大。
2013—2015年3个年度崂山湾春季游泳生物群落结构处于相对稳定和轻微扰动状态, 3个年度的ABC曲线W统计值分别为0.02、0.18和‒0.01。2013年和2014年游泳生物群落的数量优势度曲线起初位于生物量优势度曲线之上, 第2种游泳生物后, 生物量优势度曲线位于数量优势度曲线之上。2013年春季双斑蟳(Charybdis bimaculata)居生物量比例首位, 其次为口虾蛄(Oratosquilla oratoria), 两者生物量比例分别为22.11%和21.75%; 2014年春季两者生物量比例的排位发生了颠倒, 但生物量比例相对2013年都有所增加, 分别为35.24%和31.08%。2015年双斑蟳和口虾蛄的生物量比例仍占绝对优势, 分别为35.89%和21.72%, 使得游泳生物群落的生物量优势度曲线开始位于数量优势度曲线之上, 在第4种游泳生物之后, 数量优势度曲线开始位于生物量优势度曲线之上。
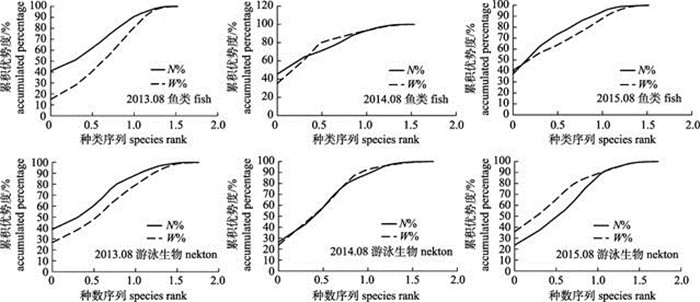
2.2 夏季崂山湾鱼类与游泳生物群落结构ABC曲线图 3为2013—2015年3个年度夏季崂山湾鱼类与游泳生物数量与生物量的ABC曲线图。
|
图 3 2013—2015年夏季崂山湾鱼类与游泳生物群落结构的数量生物量曲线 Fig.3 The summer ABC curves of fish and nekton community structure in Laoshan Bay during 2013–2015 |
2013—2015年3个年度崂山湾夏季鱼类群落结构处于扰动和相对稳定状态。2013年鱼类群落的数量优势度曲线远高于生物量优势度曲线, 其W统计值为‒1.16, 群落结构都处于扰动状态。2014年鱼类群落数量优势度曲线开始位于生物量优势度曲线上, 第3种鱼开始, 生物量优势度曲线位于数量优势度曲线上, 后期两者重合, 其W统计值为0.13, 群落结构都处于相对稳定状态。该年度小黄鱼(Larimichthys polyactis)的数量和生物量比例远高于其他生物, 都占首位, 分别为45.58%和35.30%, 单位个体平均质量为12.81 g。因小黄鱼小个体数量太多, 鱼类总的生物量优势度曲线仍低于数量优势度曲线。2015年鱼类群落的生物量优势度曲线开始位于数量优势度曲线之上, 在第2种鱼后, 生物量优势度曲线立即位于数量优势度曲线之下, 后期两者重合, 其W统计值为‒0.50。群落结构都处于扰动状态。该年度小黄鱼生物量比例大幅提高, 达40.55%, 单位个体平均质量较2014年夏季提高了11.30%, 为14.26, 使得生物量优势度曲线开始位于数量优势度曲线之上。生物量紧随其后的小个体赤鼻棱鳀(Thrissa kammalensis), 其加入使得鱼类群落的生物量优势度曲线立即位于数量优势度曲线之下。
2013—2015年3个年度崂山湾夏季游泳生物群落结构处于扰动和相对稳定状态。2013年游泳生物群落的数量优势度曲线远高于生物量优势度曲线, 其W统计值为‒0.78, 群落结构处于扰动状态。2014年游泳生物群落数量优势度曲线开始位于生物量优势度曲线上, 第2种游泳生物开始, 两者重合, 第6种游泳生物后, 生物量优势度曲线位于数量优势度曲线之上, 后期两者重合, 其W统计值为0.08, 群落结构处于相对稳定状态。2015年夏季崂山湾游泳生物群落生物量优势度曲线开始远高于数量优势度曲线, 第12种游泳生物之后, 2种优势度曲线开始重合, 其W统计值为0.77, 群落结构处于相对稳定状态。
3 讨论目前国内增殖放流通常选择种苗培育技术成熟、能够大批量培育, 而且培育成本低、生长快、经济价值高的土著种类, 以缩短拟放流海区的食物链, 提高海区的资源量, 达到资源增殖的目的[16]。但增殖放流后, 放流海域种间生态关系的匹配及群落结构的稳定研究相对较少, 而这恰好是生态放流的关键所在[17]。目前国外增殖放流分为3种类型, 即增加资源量放流、改变生态结构放流和生态修复放流[18]。
3.1 崂山湾鱼类与游泳生物群落结构稳定性对比发现, 2013—2015年3个年度崂山湾春季游泳生物群落结构较鱼类群落结构稳定性大大增加, 分析两者的种类组成发现:游泳生物种类组成中3个年度生物量比例居前2位都为双斑蟳和口虾蛄, 其和分别为43.86%、66.33%和57.61%。2013—2015年春季鱼类群落结构中种类生物量比例居前2位的分别为皮氏叫姑鱼和丝虾虎鱼(Cryptocentrus filifer)、皮氏叫姑鱼和短吻红舌鳎及短吻红舌鳎和皮氏叫姑鱼; 3个年度中游泳生物群落结构中种类生物量比例居前2位的鱼类也分别是这几种鱼类, 但其在总游泳生物中生物量比例排名分别第4和第6、第4和第5、第3和第7, 排名有不同幅度的下降。甲壳类生物的加入, 使得春季崂山湾游泳生物群落结构较鱼类群落结构稳定性有所增强, 推测虾蟹类在崂山湾水域可能起着较重要的生态维稳作用。
对比崂山湾夏季游泳生物群落结构与鱼类群落结构稳定性, 发现除2013年外, 2014年与2015年游泳生物群落结构较鱼类群落结构稳定性大大增加。2013—2015年夏季崂山湾游泳生物种类组成中, 生物量比例居前2位都为甲壳类生物, 分别为口虾蛄和戴氏赤虾(Metapenaeopsis dalei)、三疣梭子蟹(Portunus Trituberculatus)和口虾蛄及口虾蛄和三疣梭子蟹, 两者生物量比例之和分别为38.27%、44.38%和53.26%。3个年度鱼类群落结构中种类生物量比例居前2位的分别为小眼绿鳍鱼(Chelidonichthys spinosus)和短吻红舌鳎、小黄鱼和斑鰶(Konosirus punctatus)及小黄鱼和赤鼻棱鳀; 同期游泳生物群落结构中种类生物量比例居前2位的鱼类也分别是这几种鱼类, 但其在总游泳生物中生物量比例的排名分别第6和第7、第3和第5、第4和第6, 排名有不同幅度的下降。与春季一样, 随着甲壳类生物的加入, 夏季崂山湾游泳生物群落结构较鱼类群落结构稳定性有所增强, 推测判断虾蟹类可能加强了崂山湾渔业资源种类生物量与数量的合理分配, 在崂山湾水域起着一定的生态维稳作用。2013年夏季崂山湾游泳生物群生物量比例居前2位的口虾蛄和戴氏赤虾基本为当年补充群体, 其单位个体平均质量较小, 为5.66 g/ind, 较2014年与2015年居前2位生物的单位个体平均质量44.39 g/ind和53.26 g/ind大幅下降, 导致其群落结构稳定下降。
时间变化是生态系统的一个基本特征, 自然和人为的干扰破坏了生态系统的稳定性, 使生态系统处于一种过渡状态, 其格局和过程发生变化, 造成系统结构和功能的破损[19-21]。生态系统演替的时间尺度不一[19, 22-24], 已有的生态系统结构与功能变化研究通常集中于中小时间尺度的演替, 长时间的物理环境变化与极长时间的生物进化研究相对较少。戴本林等[25]借鉴河流与湿地生态系统时间尺度的分级, 初步明确了近海生态系统健康评价的短、中、长、极长时间尺度, 认为短尺度时间为天与季节, 研究内容多集中于水质、底质、生物、栖息地与生物残毒等内容; 中尺度时间为一年或几年, 研究内容多集中于海岸带状况、海域面积、景观、降雨量、年径流量和淡水输入量等内容。
通常认为食物的可获率和被捕食概率是影响种群动力学和物种演替的主要原因之一[26]。Brodeur等[27]研究了美国华盛顿和俄勒冈州沿岸上升流区域的食物网结构, 并比较了4年间(1981—1984)的变化情况, 发现食物网发生了很大的年际变化。本研究时间序列相对较短, 为3年, 有时间序列上的年间纵向与横向对比, 在一定程度上能反映崂山湾渔业资源群落结构的变化, 如能对崂山湾及其周边海域的渔业资源的长期变化情况进行综合分析, 研究结果将更加科学合理。
3.2 崂山湾放流种类与渔业资源群落结构稳定性通常稳定的群落包括各种形态及各种门类的种类, 而受扰动群落, 物种多样性低, 即使物种多样性可能相同的两个群落, 其多样性等级水平也可能不同, 抗干扰能力也不同[28]。水生生态系统内特定群落结构, 特别是鱼类的群落结构, 反映了生态系统的退化程度[28]。崂山湾鱼类群落结构相对简单, 季节与年际变化较大, 虾蟹类丰富了该水域渔业资源的群落结构, 使得崂山湾渔业资源群落相对更合理, 更稳定。究其原因, 可能是甲壳类生物群体的加入, 局部改变或降低了群落内的捕食压力, 具体原因有待系统深究。
研究发现甲壳类生物有助于增强崂山湾渔业资源群落结构, 可考虑增殖放流甲壳类生物; 目前崂山湾主要放流中国对虾(Fenneropenaeus chinensis)和三疣梭子蟹。本文对比了2013—2015年3个年度春夏两季鱼类与游泳生物ABC曲线、W统计值及其种类贡献的时空格局, 可以看出不管是春季还是夏季, 游泳生物相比鱼类, 其群落结构各年度稳定性基本上都大幅增强; 仅2014年夏季鱼类群落结构稳定性高于游泳生物, 但两者都处于相对稳定状态。研究包含同期的横向与同区的纵向比较, 可排除洄游种对群落结构稳定的干扰, 研究结果体现了三疣梭子蟹在崂山湾海域渔业资源群落结构中可能存在维稳功能。
李增[29]统计评估了山东半岛南部靖海湾、五垒岛湾、乳山湾、丁字湾、崂山湾和黄家塘湾等海湾2010—2013年三疣梭子蟹的增殖放流效果, 发现山东半岛沿线海湾是适宜的三疣梭子蟹放流地点, 放流群体的加入对海区三疣梭子蟹的恢复起了关键作用, 成为资源群体的主体, 其年回捕量约为5897.26 t, 创造了巨大的经济效益。李增等[30]详细分析了2012年山东半岛南部沿线此6个海湾渔业资源丰度生物量曲线变化, 发现三疣梭子蟹增殖放流后, 6个海湾渔业资源群落结构发生了变化, 群落结构受干扰程度由重度干扰变为中度干扰, 群落结构质量在一定程度上发生了改善。其中崂山湾生物均匀度指数由放流前的最低增长为放流后的最高, 生物多样性指数也有一定程度的增加。结果也验证了三疣梭子蟹在崂山湾海域渔业资源群落结构中可能存在维稳功能。
研究证实鱼类群落结构的变化能反映生态系统的退化程度[31-32], 更多研究发现在干扰小, 相对稳定的生态系统中, 底栖生物和肉食性生物的存在比例要远高于严重受干扰, 有所退化的生态系统, 且随着干扰退化的加剧, 营养结构中的高营养级肉食性生物, 将首先消失, 其后依次是底栖生物食性的生物、浮游生物食性的生物和杂食性生物, 即底栖生物对生态系统退化与失调的耐受能力要高于大多数高营养级的肉食性鱼类, 更能维持生态系统的结构与功能[31, 33], 特别是底栖生物中大型底栖无脊椎生物在一定程度更能反映生态系统受干扰退化的程度[34-35]。人类活动与外界环境的变化, 能改变水体沉积物的氧化还原反应, 进而影响其营养流, 这种影响迅速直接, 加之底栖生物对环境扰动的高耐受性, 当底栖生物的群落结构发生大幅度变动时, 其所处生态系统已发生大幅度的变动[35]。本文研究结果在一定程度上也证实崂山湾的底栖生物能维持其生态系统的稳定性。
诸多研究证实增殖放流种类在一定程度上能改变或增强渔业资源群落结构。Tomiyama等[36]提及日本福岛县1996年牙鲆(Paralichthys olivaceus)增殖效果的下降, 其中之一的原因是没有考虑其种群动态。Han等[37]通过Ecopath模型能流分析发现, 尽管胶州湾的初级生产力较高, 但大量的贝类养殖削减了初级生产力对渔业资源的生产支持; 林会洁等[38]发现海洋牧场不同的增殖种类会影响生态系统的稳定; 李朝文等[39]发现在马鞍列岛海洋牧场同时增殖褐菖鲉(Sebastiscus marmoratus)和小黄鱼(Larimichthys polyactis)会影响其生态系统稳定性; 宋普庆等[40]研究发现2013年前后几年福建三都澳海湾放流了大黄鱼(Pseudosciaena crocea)、中国对虾、鲈(Lateolabrax japonicus)、曼氏无针乌贼(Sepiella maindroni)等增殖种类, 但只有大黄鱼资源量有所恢复, 且在维持游泳生物群落结构稳定性方面起着重要作用。沈新强等[41]采用群落结构测度公式、群落的季节更替指数和迁移指数, 调查发现增殖放流的大黄鱼和三疣梭子蟹有效增加了杭州湾增殖放流海域群落多样性, 改善了渔业资源的群落结构。
4 小结目前崂山湾水域主要放流中国对虾和三疣梭子蟹2个品种。李忠义等[42]和袁伟等[43]分别就基础饵料生物丰度、生长拐点、最大日体重增长量、日平均增长速度、渐近体长与开捕体重等生长参数, 及放流群体与自然群体的比例, 验证了崂山湾适宜中国对虾生长, 是适合的中国对虾放流点。因本研究数据来源于拖网调查结果, 捕捞不到足够的中国对虾; 另黄渤海放流后的大部分中国对虾在开捕后即被捕捞殆尽, 无法对自然群体进行补充与恢复, 形成不放流就没有中国对虾可捕的窘境, 来年补充群体资源量很少。本研究结果难以确证其维持渔业资源群落结构稳定性的重要性。中国对虾和口虾蛄的生活习性差不多, 口虾蛄在崂山湾春夏季游泳生物群落结构中起着重要的维稳作用, 如中国对虾在次年春季能维持一定的资源量, 可能也会如口虾蛄一样, 在春夏季游泳生物群落结构中起着一定的维稳作用。本研究证实了崂山湾三疣梭子蟹有助于增强其渔业资源群落结构, 因此在崂山湾渔业资源增殖放流品种甄选中, 可重点考虑三疣梭子蟹, 后期需确定其适宜的增殖容量以高效稳固渔业资源群落结构的稳定性。
合理选择增殖放流种类是渔业资源增殖放流中的首要关键环节, 是确保增殖放流效果的前提条件。Post[44]研究发现群落结构的历史状况、资源可获率、捕食与被捕食关系类型、生态系统波动程度及生态系统大小等一起影响食物链的长度, 且存在时间和地点的差异。之前研究没有将增殖种类的甄选与放流海域渔业资源群落结构及生态系统稳定性有机结合起来, 本文基于渔业资源群落结构稳定性尝试探讨遴选崂山湾海域增殖放流种类, 具有一定的科学参考价值。但目前ABC曲线没有详细的干扰标准, 评价结果稍显粗略, 尚需更多的研究加以证实。
| [1] |
Kitada S. Economic, ecological and genetic impacts of marine stock enhancement and sea ranching:A systematic review[J]. Fish and Fisheries, 2018, 19(3): 511-532. DOI:10.1111/faf.12271 |
| [2] |
Lee M O, Otake S, Kim J K. Transition of artificial reefs (ARs) research and its prospects[J]. Ocean & Coastal Management, 2018, 154: 55-65. |
| [3] |
Ziemann D A. The potential for the restoration of marine ornamental fish populations through hatchery releases[J]. Aquarium Sciences and Conservation, 2001, 3(1-3): 107-117. |
| [4] |
Jackson J B C, Kirby M X, Berger W H, et al. Historical overfishing and the recent collapse of coastal ecosystems[J]. Science, 2001, 293(5530): 629-637. DOI:10.1126/science.1059199 |
| [5] |
Bakun A. Wasp-waist populations and marine ecosystem dynamics:Navigating the "predator pit" topographies[J]. Progress in Oceanography, 2006, 68(2-4): 271-288. DOI:10.1016/j.pocean.2006.02.004 |
| [6] |
Mustafa S. Stock enhancement and sea ranching:Objectives and potential[J]. Reviews in Fish Biology and Fisheries, 2003, 13(2): 141-149. DOI:10.1023/B:RFBF.0000019476.87730.3b |
| [7] |
Loneragan N R, Jenkins G I, Taylor M D. Marine stock enhancement, restocking, and sea ranching in Australia:Future directions and a synthesis of two decades of research and development[J]. Reviews in Fisheries Science, 2013, 21(3-4): 222-236. DOI:10.1080/10641262.2013.796810 |
| [8] |
Tanaka T, Ota Reviving the Seto Inland Sea. Japan: Applying the principles of Satoumi for marine project in Okayama[C]//Proceedings of the 15th French-Japanese Oceanography Symposium. Marine Productivity: Perturbations and Resilience of Socio-ecosystems. Cham: Springer, 2015: 291-294.
|
| [9] |
Taylor M D, Chick R C, Lorenzen K, et al. Fisheries enhancement and restoration in a changing world[J]. Fisheries Research, 2017, 186(2): 407-412. |
| [10] |
Li Z Y, Wu Q, Shan X J, et al. Keystone species of fish community structure in the Bohai Sea[J]. Journal of Fishery Sciences of China, 2018, 25(2): 229-236. [李忠义, 吴强, 单秀娟, 等. 渤海鱼类群落结构关键种[J]. 中国水产科学, 2018, 25(2): 229-236.] |
| [11] |
Lee S G, Rahimi Midani A. National comprehensive approaches for rebuilding fisheries in South Korea[J]. Marine Policy, 2014, 45: 156-162. DOI:10.1016/j.marpol.2013.12.010 |
| [12] |
Nobutake K. Footprints of cultivated fisheries for the past 50 years, toward to the abundant marine fishery[J]. Fisheries Economics Research, 2014, 58(2): 39-43. [小岩信竹. 栽培漁業50年の足跡-豊饒の海へ[J]. 漁業経済研究, 2014, 58(2): 39-43.] |
| [13] |
Warwick R M. A new method for detecting pollution effects on marine macrobenthic communities[J]. Marine Biology, 1986, 92(4): 557-562. DOI:10.1007/BF00392515 |
| [14] |
Blankenship H L, Leber K M. Responsible approach to marine stock enhancement[C]//Proceedings of the American Fisheries Society Symposium. New York: American Fisheries Society, 1995, 15: 167-175.
|
| [15] |
Yemane D, Field J G, Leslie R W. Exploring the effects of fishing on fish assemblages using abundance biomass comparison (ABC) curves[J]. ICES Journal of Marine Science, 2005, 62(3): 374-379. DOI:10.1016/j.icesjms.2005.01.009 |
| [16] |
Jouffre D, Inejih C A. Assessing the impact of fisheries on demersal fish assemblages of the Mauritanian continental shelf, 1987-1999, using dominance curves[J]. ICES Journal of Marine Science, 2005, 62(3): 380-383. DOI:10.1016/j.icesjms.2004.11.007 |
| [17] |
Fujita T, Inada T, Ishito Y. Density, biomass and community structure of demersal fishes off the Pacific coast of northeastern Japan[J]. Journal of Oceanography, 1993, 49(2): 211-229. DOI:10.1007/BF02237289 |
| [18] |
Cowx I G. Stocking strategies[J]. Fisheries Management and Ecology, 1994, 1(1): 15-30. DOI:10.1111/j.1365-2400.1970.tb00003.x |
| [19] |
Turner M G. Landscape Heterogeneity and Disturbance[M]. New York: Springer, 1987: 239.
|
| [20] |
Peng S. The Dynamics of Community in Southern Subtropical Forest[M]. Beijing: Science Press, 1996.
|
| [21] |
Johnson E A. Fire and Vegetation Dynamics:Studies from the North American Boreal Forests[M]. Cambridge: Cambridge University Press, 1992: 129.
|
| [22] |
Kimmins J P. Forest Ecology[M]. 2 edition. New Jersey: Prince Hall, 1996: 596.
|
| [23] |
Smith R L. Ecology and Field Biology[M]. New York and London: Harper & Row Publishers, 1966: 686.
|
| [24] |
Ricklefs R E. Ecology[M]. 2 edition. New York: Chiron Press, 1979: 966.
|
| [25] |
Dai B L, He Y L. Temporal-spatial scale problem of offshore ecosystem health assessment[J]. Water Saving Irrigation, 2012(6): 60-63. [戴本林, 贺玉龙. 近海生态系统健康评价的时空尺度问题研究[J]. 节水灌溉, 2012(6): 60-63.] |
| [26] |
Dai B L, He Y L. Temporal-spatial scale problem of offshore ecosystem health assessment[J]. Water Saving Irrigation, 2012, 6: 60-63. [戴本林, 贺玉龙. 近海生态系统健康评价的时空尺度问题研究[J]. 节水灌溉, 2012, 6: 60-63.] |
| [27] |
Brodeur R D, Pearcy W G. Effects of environmental variability on trophic interactions and food web structure in a pelagic upwelling ecosystem[J]. Marine Ecosystem Process Series, 1992, 84: 101-119. DOI:10.3354/meps084101 |
| [28] |
Wichert G A, Rapport D J. Fish community structure as a measure of degradation and rehabilitation of riparian systems in an agricultural drainage basin[J]. Environmental Management, 1998, 22(3): 425-443. DOI:10.1007/s002679900117 |
| [29] |
Li Z. The assessment of Portunus trituberctdatus stock enhancement in southern Shandong Peninsula[D]. Yantai: Yantai University, 2014: 50-55. [李增.山东半岛南部三疣梭子蟹增殖放流效果评价[D].烟台: 烟台大学, 2014: 50-55.] http://cdmd.cnki.com.cn/Article/CDMD-11066-1014062354.htm
|
| [30] |
Li Z, Qiu S Y, Zhang J H, et al. Preliminary analysis of fishery community structure in southern Shandong Peninsula before and after Portunus trituberctdatus releasing[J]. Journal of Yantai University (Natural Science and Engineering Edition), 2014, 27(3): 184-190. [李增, 邱盛尧, 张金浩, 等. 山东半岛南部三疣梭子蟹放流前后渔业生物群落结构初步分析[J]. 烟台大学学报(自然科学与工程版), 2014, 27(3): 184-190. DOI:10.3969/j.issn.1004-8820.2014.03.006] |
| [31] |
Wichert G A, Rapport D J. Fish community structure as a measure of degradation and rehabilitation of riparian systems in an agricultural drainage basin[J]. Environmental Management, 1998, 22(3): 425-443. DOI:10.1007/s002679900117 |
| [32] |
Das S K, Chakrabarty D. The use of fish community structure as a measure of ecological degradation:A case study in two tropical rivers of India[J]. Biosystems, 2007, 90(1): 188-196. DOI:10.1016/j.biosystems.2006.08.003 |
| [33] |
Karr J R, Dudley D R. Ecological perspective on water quality goals[J]. Environmental Management, 1981, 5(1): 55-68. DOI:10.1007/BF01866609 |
| [34] |
Cummins K W. Field procedures for analysis of functional feeding groups of stream macroinvertebrates[M]. University of Pittsburgh, Pymatuning Laboratory of Ecology, 1998: 18.
|
| [35] |
Sanjib K D, Dibyendu B, Sudipto R. Use of biotic community structure as a measure of ecological degradation[J]. Chinese Journal of Applied and Environmental Biology, 2007, 13(5): 662-667. |
| [36] |
Tomiyama T, Watanabe M, Fujita T. Community-based stock enhancement and fisheries management of the Japanese flounder in Fukushima, Japan[J]. Reviews in Fisheries Science, 2008, 16(1-3): 146-153. DOI:10.1080/10641260701681847 |
| [37] |
Han D Y, Xue Y, Zhang C L, et al. A mass balanced model of trophic structure and energy flows of a semi-closed marine ecosystem[J]. Acta Oceanologica Sinica, 2017, 36(10): 60-69. DOI:10.1007/s13131-017-1071-6 |
| [38] |
Lin H J, Qin C X, Li X G, et al. Food web analysis in Zhelin Bay marine ranching[J]. Journal of Fisheries of China, 2018, 42(7): 1026-1039. [林会洁, 秦传新, 黎小国, 等. 柘林湾海洋牧场不同功能区食物网结构[J]. 水产学报, 2018, 42(7): 1026-1039.] |
| [39] |
Li C W, Wang K, Cheng X P, et al. Difference of trophic niche between Sebastiscus marmoratus and Larimichthys polyactis in marine ranching of Ma'an Archipelago, China[J]. Chinese Journal of Applied Ecology, 2018, 29(5): 1489-1493. [李朝文, 王凯, 程晓鹏, 等. 马鞍列岛海洋牧场褐菖鲉和小黄鱼营养生态位差异[J]. 应用生态学报, 2018, 29(5): 1489-1493.] |
| [40] |
Song P Q, Lin L S, Li Y, et al. Species composition and stability of nekton community structure in Sandu Bay, Fujian Province[J]. Biodiversity Science, 2015, 23(4): 519-526. [宋普庆, 林龙山, 李渊, 等. 福建三都澳游泳动物种类组成及群落结构稳定性[J]. 生物多样性, 2015, 23(4): 519-526.] |
| [41] |
Shen X Q, Yuan Q. Characteristic analysis of nekton community structure in the enhancement area of Hangzhou Bay[J]. Marine Fisheries, 2011, 33(3): 251-257. [沈新强, 袁骐. 杭州湾增殖放流海域游泳动物群落结构特征分析[J]. 海洋渔业, 2011, 33(3): 251-257. DOI:10.3969/j.issn.1004-2490.2011.03.002] |
| [42] |
Li Z Y, Jin X S, Wu Q, et al. Studies on the Fenneropenaeus chinensis released in the Aoshan Bay[J]. Journal of Fisheries of China, 2014, 38(3): 410-416. [李忠义, 金显仕, 吴强, 等. 鳌山湾增殖放流中国明对虾的研究[J]. 水产学报, 2014, 38(3): 410-416.] |
| [43] |
Yuan W, Lin Q, Wang J, et al. Assessment of enhancement effectiveness of Chinese shrimp Fenneropenaeus chinensis stock in the Laoshan Bay[J]. Progress in Fishery Sciences, 2015, 36(4): 27-34. [袁伟, 林群, 王俊, 等. 崂山湾中国对虾(Fenneropenaeus chinensis)增殖放流的效果评价[J]. 渔业科学进展, 2015, 36(4): 27-34.] |
| [44] |
Post D M. The long and short of food-chain length[J]. Trends in Ecology & Evolution, 2002, 17(6): 269-277. |
 2020, Vol. 27
2020, Vol. 27

