2. 江苏省海洋水产研究所, 江苏 南通 226007;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306
2. Jiangsu Research Institute of Marine Fisheries, Nantong 226007, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China
小黄鱼(Larimichthys polyactis)和棘头梅童鱼(Collichthys lucidus)同属鲈形目(Perciformes), 石首鱼科(Sciaenidae), 是暖温性底层鱼类, 喜泥质或泥沙底质海区, 生长迅速, 肉质鲜美, 营养价值高, 是中国近海渔业生产主要的捕捞对象[1]。随着捕捞力量和生产效率快速提高, 近海渔业普遍遭受不同程度的过度捕捞, 小黄鱼和棘头梅童鱼资源量也出现了持续衰退等问题[2]。吕泗渔场位于黄海西南部, 江苏省海岸东部, 是中国重要的群众作业渔场之一。苏北沿岸水和长江冲淡水为主的沿岸低盐水和外海高盐水混合使得该海域浮游生物丰富, 适合鱼类产卵[3], 因此, 吕泗渔场是洄游性鱼类重要的索饵育肥地, 是东、黄海大黄鱼(Larimichthys crocea)、小黄鱼主要的产卵场之一。目前, 关于吕泗渔场的生物学研究主要停留在生态类群结构[4], 生物时空分布[5]及生境履历重建[6]等, 对吕泗渔场小黄鱼和棘头梅童鱼摄食生态的研究较少, 而鱼类食性研究是探索海洋生态系统物质能量流动的重要环节, 是制定渔业资源保护、修复政策的重要参考, 因此, 对吕泗渔场小黄鱼和棘头梅童鱼食性研究有较高的理论价值。
脂类是生物体储能、供能物质, 而脂肪酸是生物脂类的主要构成成分, 存在形式为三羧酸甘油酯和磷脂, 属非极性, 在生物摄食、同化过程中化学性质稳定, 是典型的生物标志物, 脂肪酸标记法相对于传统食性分析法, 偶然性较低、样本量需求少, 能指示一段时间综合摄食信息等[7]。根据2018年秋季(10月)吕泗渔场渔业资源调查所取样本, 对该海域小黄鱼和棘头梅童鱼脂肪酸组成和食性分析, 旨在为小黄鱼和棘头梅童鱼资源合理开发利用提供参考。
1 材料与方法 1.1 样本采集实验对象为小黄鱼和棘头梅童鱼, 实验样品取自2018年秋季(10月)吕泗渔场渔业资源调查, 调查区域为32.38°N~32.99°N, 121.29°E~122.19°E, 属黄海西南部吕泗渔场海域, 调查船主机270 kW, 渔具采用单船有翼单囊底拖网, 每站拖曳25 min, 拖速3.6 kn左右, 取样站位如图 1所示。本次取样以10 mm体长间隔划分体长组, 每个体长组样本3~8尾, 共取得小黄鱼有效样本46尾, 棘头梅童鱼有效样本36尾, 渔获物样本采集后先保存于–20 ℃, 带回实验室后立即处理。
|
图 1 吕泗渔场2018年秋季采样站位 Fig.1 Sampling locations of Lyusi fishing ground during autumn 2018 |
在实验室充分解冻后, 测量小黄鱼和棘头梅童鱼体长、体重, 取第一背鳍附近白肌, 尽量多取, 超纯水冲洗干净后冷冻干燥30 h, 使用混合球磨仪研磨成粉末, 装入离心管以供脂肪酸提取。本实验采用Folch法[8]提取脂肪酸, 称取200 mg粉末, 加入15 mL三氯甲烷-甲醇溶液(体积比2:1), 浸泡22 h以上, 离心过滤后取上清液, 加入NaCl溶液(0.9%), 取下层溶液于圆底烧瓶中, 水浴蒸发后得到粗脂。脂肪酸甲酯化参照GB/T 17376-2008《动植物油脂脂肪酸甲酯制备》三氟化硼-甲醇法[9], 在粗脂中加入4 mL氢氧化钾-甲醇溶液(0.5 mol/L), 水浴回流加热8 min后加入4 mL三氟化硼-甲醇溶液, 25 min后加入4 mL正己烷, 回流萃取2 min, 冷却至室温后加入15 mL饱和NaCl溶液, 静置分层, 然后将正己烷层与50 mg/L的十九烷酸甲酯以1:1比例混合, 移至色谱进样瓶中待测。脂肪酸测定采用气相色谱质谱联用仪(GC-MS), 色谱柱型号Agilent HP-88(60 m×0.25 nm×0.20 μm), 分流比10:1, 载气为高纯氦气。升温程序:初始温度125℃, 然后以8℃/min升温至145℃, 保持26 min后再以2℃/min升温至220℃, 保持1 min后再以1℃/min上升至227℃, 保持1 min。
1.3 数据处理实验中参照37种脂肪酸甲酯混标的保留时间进行定性分析, 并利用十九烷酸甲酯标准品进行定量分析, 内标法计算脂肪酸质量分数, 单位mg/g, 其中内标回收率皆在74%以上, 分析精度±0.01%,
| $ {X_i} = {F_i} \times \frac{{{A_i}}}{{{A_{19}}}} \times \frac{{{m_{19}}}}{m} \times 100{\rm{\% }} $ |
式中, Xi 为待测样品组分 i 的含量(mg/g); Ai 是组分i的峰面积; m 是样品质量; m19 是内标物十九烷酸甲酯的质量; A19 是待测样品中内标物的峰面积; Fi 是组分与内标物的校正因子之比, 即相对校正因子。
通过多元统计分析数据, 主成分分析是探究多元事物的主要影响因素, 通过降维将多个相互关联的数值转化成少数互不相关的指标, 利用一部分脂肪酸信息涵盖总脂肪酸信息, 聚类分析Ward法则用以分析数据之间的相似性, 明确划分成组, 单因素方差分析和多重比较可检验脂肪酸含量与体长的关系。统计分析均使用SPSS 20.0和Origin 2018。
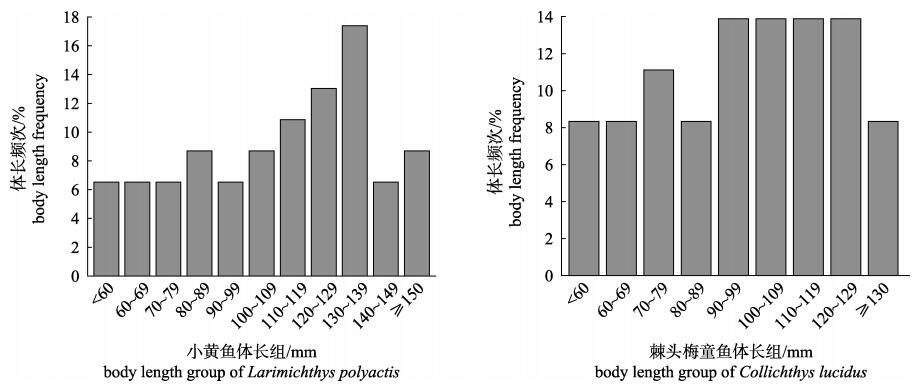
2 结果与分析 2.1 体长体重组成小黄鱼体长范围55~190 mm, 平均体长(118.23±30.21) mm, 体长频次见图 2, 体重范围2.80~62.48 g, 平均体重(16.86±10.96) g, 体长与体重的幂函数关系式为W=0.0002L2.3101 (R2=0.8601, n=46, P < 0.01);棘头梅童鱼体长范围50~170 mm, 平均体长(103.25±25.05) mm, 体长频次见图 2, 体重范围2.81~36.46 g, 平均体重(11.35±6.76) g, 体长与体重的幂函数关系式为W=0.0005L2.1536, (R2=0.8351, n=36, P < 0.01)。
|
图 2 吕泗渔场2018年秋季小黄鱼、棘头梅童鱼体长频次百分比 Fig.2 Standard length frequency percentage of Larimichthys polyactis and Collichthys lucidus from Lyusi fishing ground during autumn 2018 |
研究中小黄鱼和棘头梅童鱼脂肪酸种类相同, 共34种(表 1), 质量含量分别为19.39 mg/g和21.77 mg/g, 包括14种饱和脂肪酸(saturated fatty acid, SFA) (C10:0、C11:0、C12:0、C13:0、C14:0、C15:0、C16:0、C17:0、C18:0、C20:0、C21:0、C22:0、C23:0、C24:0), 分别占其总脂肪酸的36.09%和36.17%; 9种单不饱和脂肪酸(monounsaturated fatty acid, MUFA) (C14:1n5、C15:1n5、C16:1n7、C17:1n7、C18:1n9t、C18:1n9c、C20:1、C22:1n9、C24:1n9), 分别占其总脂肪酸的13.64%和15.92%; 11种多不饱和脂肪酸(polyunsaturated fatty acid, PUFA) (C18:2n6t、C18:2n6c、C18:3n6、C18:3n3、C20:2、C20:3n6、C20:3n3、C20:4n6、C22:2n6、C20:5n3、C22:6n3), 分别占其总脂肪酸的50.26%和47.91%。小黄鱼和棘头梅童鱼SFA、PUFA显著高于MUFA (P < 0.01), PUFA/SFA比值分别为1.43±0.31和1.37±0.4, n-3系脂肪酸显著高于n-6系脂肪酸(P < 0.01), n-3/n-6比值分别为4.09±0.63和3.35±0.46。
|
|
表 1 吕泗渔场2018年秋季小黄鱼、棘头梅童鱼脂肪酸组成 Tab.1 Fatty acid compositions of Larimichthys polyactis and Collichthys lucidus from Lyusi fishing ground during autumn 2018 |
经统计分析可知(表 1), 小黄鱼和棘头梅童鱼C16:1n7、C17:1n7、C18:1n9c (单不饱和脂肪酸), C18:2n6c、C20:2、C20:3n3、C20:4n6、C20:5n3 (EPA)、C22:2n6、C22:6n3 (DHA) (多不饱和脂肪酸), C15:0 (饱和脂肪酸), MUFA、PUFA、n-3、n-6、n-3/n-6、DHA/EPA存在显著差异(P < 0.05)。
选取百分含量大于1%的脂肪酸进行主成分分析, 发现小黄鱼4个主成分初始特征值同时大于1.00且方差贡献率分别为29.11%、20.17%、16.66%、10.51%, 累计76.45%, 说明这4个主成分包含的要素信息可以涵盖小黄鱼总脂肪酸含量信息, 结合成分矩阵结果(表 2), 对第一主成分贡献率较高的脂肪酸为C16:0、C20:3n3、C20:4n6、C22:2n6, 对第二主成分贡献率较高的为C14:0、C18:2n6c、C22:6n3 (DHA), 对第三主成分贡献率较高的为C16:1n7、C18:2n6t、C20:5n3 (EPA), 对第四主成分贡献率较高的为C18:0;棘头梅童鱼3个主成分初始特征值大于1.00且方差贡献率分别为38.98%、20.04%、15.35%, 累计74.37%, 对第一主成分贡献率较高的脂肪酸为C16:1n7、C18:1n9c、C20:4n6、C20:3n3、C22:2n6、C22:6n3 (DHA), 对第二主成分贡献率较高的为C17:0、C18:2n6t、C18:2n6c, 对第三主成分贡献率较高的为C14:0、C16:0。
|
|
表 2 吕泗渔场2018年秋季小黄鱼、棘头梅童鱼成分得分系数矩阵 Tab.2 Component score coefficient matrix of Larimichthys polyactis and Collichthys lucidus from Lyusi fishing ground during autumn 2018 |
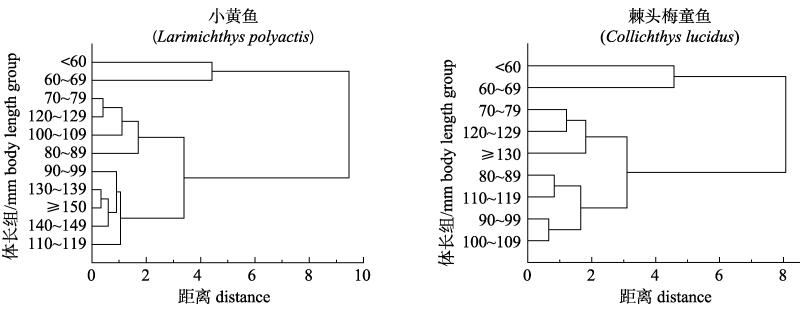
各体长组脂肪酸种类一致, 包括14种饱和脂肪酸、9种单不饱和脂肪酸和11种多不饱和脂肪酸, SFA、PUFA质量分数均显著高于MUFA (P < 0.05), n-3均显著高于n-6 (P < 0.05)。聚类分析结果如图 3所示, 在距离4处小黄鱼和棘头梅童鱼可分为3组, 第一组体长 < 60 mm, 第二组体长60~69 mm, 第三组体长≥70 mm, 因此, 在体长60 mm和70 mm时, 两种鱼类脂肪酸含量发生明显转变。根据体长和脂肪酸含量的Pearson相关性检验结果可知(表 3, 由于数据较多, 本表仅展示呈显著相关的结果), 小黄鱼C18:0、C18:2n6c、C20:5n3 (EPA)、C22:2n6、n-6与体长呈显著负相关(P < 0.05), DHA/EPA、n-3/n-6与体长呈显著正相关(P < 0.05)。棘头梅童鱼C18:0、C18:2n6c、PUFA/SFA与体长呈显著负相关(P < 0.05), C24:1n9、SFA与体长呈显著正相关(P < 0.05), 其中SFA与体长呈极显著正相关(r=0.984, P < 0.01)。由单因素方差分析和多重比较结果可知, 小黄鱼C18:2n6c、C20:5n3、C22:2n6、DHA/EPA体长组间具显著差异(P < 0.05), C18:2n6c在体长 < 120 mm和体长≥120 mm时具显著差异(P < 0.05), C20:5n3 (EPA)、C22:2n6在体长 < 70 mm和体长≥70 mm时具显著差异(P < 0.05), 其他脂肪酸规律不明显; 棘头梅童鱼C15:1n5、C18:0、C18:2n6c、C20:1、C22:1n9、PUFA/SFA、SFA体长组间具显著差异(P < 0.05), C15:1n5在体长70~90 mm与体长 < 60 mm、体长≥110 mm时具显著差异(P < 0.05), C18:2n6c在体长 < 70 mm与体长≥100 mm时具显著差异(P < 0.05), C20:1在体长90~100 mm与体长 < 60 mm、体长≥110 mm时具显著差异(P < 0.05), C22:1n9在体长 < 60 mm与体长≥70 mm时具显著差异(P < 0.05), 其他脂肪酸规律不明显。
|
图 3 吕泗渔场2018年秋季小黄鱼、棘头梅童鱼体长组脂肪酸含量聚类分析 Fig.3 Cluster analysis diagram of fatty acid content in different length groups of Larimichthys polyactis and Collichthys lucidus from Lyusi fishing ground during autumn 2018 |
|
|
表 3 吕泗渔场2018年秋季小黄鱼、棘头梅童鱼体长与脂肪酸含量的相关性分析 Tab.3 Correlation analysis between length and fatty acid content of Larimichthys polyactis and Collichthys lucidus from Lyusi fishing ground during autumn 2018 |
对食性具有指示作用的脂肪酸称为特征脂肪酸, 其中特征脂肪酸及其指示见表 4。
|
|
表 4 特征脂肪酸及其指示 Tab.4 Signature fatty acids and their sources |
小黄鱼和棘头梅童鱼具显著差异的特征脂肪酸有C16:1n7、C18:1n9c、C20:4n6、C20:5n3 (EPA)、C22:6n3 (DHA)。主成分特征脂肪酸有C16:1n7、C18:2n6c、C18:2n6t、C20:4n6、C20:5n3 (EPA)、C22:2n6、C22:6n3 (DHA)和C16:1n7、C17:0、C18:1n9c、C18:2n6c、C18:2n6t、C20:4n6、C22:2n6、C22:6n3 (DHA), 这些特征脂肪酸所指示的食源对其摄食贡献较高。小黄鱼特征脂肪酸C18:2n6c、C20:5n3 (EPA)与体长呈显著负相关, DHA/EPA与体长呈显著正相关, 棘头梅童鱼特征脂肪酸C18:2n6c与体长呈显著负相关; 小黄鱼C18:2n6c在体长 < 120 mm和体长≥120 mm时具显著差异, C20:5n3 (EPA)在体长 < 70 mm和体长≥70 mm时具显著差异, 棘头梅童鱼C18:2n6c在体长 < 70 mm与体长≥100 mm时具显著差异, C20:1在体长90~ 100 mm与体长 < 60 mm、体长≥110 mm时具显著差异。
3 讨论 3.1 脂肪酸组成小黄鱼每克脂肪中脂肪酸质量分数(19.39 mg/g)低于棘头梅童鱼(21.77 mg/g), SFA含量相似(36.00%), 小黄鱼MUFA含量(13.64%)显著低于棘头梅童鱼(15.92%), PUFA含量(50.26%)显著高于棘头梅童鱼(47.91%)。研究表明, 过多摄入SFA会增加血液中的胆固醇, 而丰富的不饱和脂肪酸则是低脂, 高碳水化合物膳食的替代方案, 日常膳食中PUFA/SFA>0.40为宜, 肉类的PUFA/SFA一般为0.10[20], 小黄鱼和棘头梅童鱼分别为1.43和1.37, 因此, 它们是维护心血管健康的优质食源; n-3能显著改善免疫力、血栓、炎症和免疫反应等, 较高的n-6则会诱发肾炎、动脉硬化、心脑血管、类风湿自身免疫性疾病等, 但n-3和n-6在生物体内存在代谢竞争抑制, n-3对各种酶的亲和力更佳, 在代谢中可以有效取代细胞膜中的n-6[21], 目前人类膳食中n-3不足、n-6过高, 提高膳食中的n-3/n-6比值至关重要, 因此n-3/n-6也是脂肪质量和鱼油营养价值的必要指标[22], 本研究小黄鱼(4.09±0.63)和棘头梅童鱼(3.35±0.46) n-3/n-6比值远大于青鱼(Mylopharyngodon piceus)、黑鱼(Channa argus)、鲫(Carassius auratus)、鳜(Siniperca chuatsi)、鲇(Silurus asotus)、刺鳅(Mastacembelus aculeatus)等常见经济水产鱼类, 它们n-3/n-6比值主要分布在0.40~1.43[23], 因此, 小黄鱼和棘头梅童鱼营养价值较高, 其中小黄鱼n-3/n-6显著高于棘头梅童鱼, 脂肪质量和营养价值更胜一筹。小黄鱼n-6与体长呈显著负相关, n-3/n-6与体长呈显著正相关, 表明随着体长增大, 小黄鱼脂肪质量不断提升, 鱼油营养价值显著提高, 大个体相对于小个体具有更高的营养价值, 棘头梅童鱼SFA与体长呈显著正相关, PUFA/SFA与体长呈显著负相关, 表明大个体棘头梅童鱼饱和脂肪酸含量较高、PUFA/SFA比值较小, 医药膳食价值下降, 因此, 小个体棘头梅童鱼更有利于改善心血管健康。
3.2 基于特征脂肪酸食性分析 3.2.1 两种鱼类食性分析选取主成分脂肪酸进行分析, 小黄鱼较高的C20:4n6表现出一定的底栖生物食性, C16:1n7指示了硅藻摄食贡献, C22:6n3 (DHA)、C20:5n3/C22:6n3 < 1则表现出甲藻食性, C18:2n6+C18:3n3、Σ22+Σ24表现了小黄鱼的陆源植物食性, Middelburg等[24]研究发现边缘海中有机物的外部来源主要为陆源输入、生活污水等, 因此, 推测小黄鱼的陆源植物食性源于吕泗渔场苏北沿岸水和长江冲淡水带来的大量陆源有机物, 同时C18:2n6+C18:3n3也可能通过大型藻类和海草获取, 由于C18:1n7含量极低, 远小于分析精度, 因此C18:1n7/C18:1n9比值< 0.5, 表现出肉食特征, 小黄鱼在具有肉食性特征的同时又具有多种植物特征脂肪酸, 说明小黄鱼杂食性且偏肉食性, 这也解释了王凯等[25]研究发现, 小黄鱼胃含物中藻类(%IRI=1.9)相对重要性指数百分比仅低于虾类(%IRI=95.4)的情况; 棘头梅童鱼较高的C20:4n6表现出底栖生物食性, C16:1n7指示了硅藻食性, 而C18:1n9指示了褐藻的摄食贡献, C22:6n3 (DHA)、C20:5n3/C22:6n3 < 1则指示了甲藻食性, Σ15+Σ17代表了细菌食性, 但棘头梅童鱼不太可能直接摄食细菌, 因此推测Σ15和Σ17来源于有机碎屑[26], 棘头梅童鱼C18:2n6+ C18:3n3、Σ22+Σ24同样表现出陆源植物食性, 同时C18:2n6+C18:3n3也可能由大型藻类和海草获得, 由于C18:1n7含量极低, 因此C18:1n7/C18:1n9比值< 0.5, 说明棘头梅童鱼具肉食性, 由于多种植物特征脂肪酸都对其具有一定摄食贡献, 因此, 棘头梅童鱼杂食性且偏肉食性。棘头梅童鱼C16:1n7、C18:1n9c、C20:4n6和C20:5n3 (EPA)显著高于小黄鱼, 表明浮游动物、褐藻、硅藻和底栖生物对棘头梅童鱼的摄食贡献高于小黄鱼, 而小黄鱼C22:6n3 (DHA)显著更高, 体现了甲藻对小黄鱼摄食贡献率更高。
由于DHA/EPA会随着营养级的增加而增加, 因此DHA/EPA可以间接指示生物营养级, 对比小黄鱼(2.6~5.9)和棘头梅童鱼(2.6~3.3) DHA/EPA, 发现小黄鱼营养级高于棘头梅童鱼且部分重合, 且小黄鱼和棘头梅童鱼主成分脂肪酸组成相似性高达82%, 而鱼类脂肪酸组成主要受遗传基因、生活环境和摄食习性决定[12], 因此, 推测两者存在生态位的重合。
3.2.2 体长与食性转变分析小黄鱼C18:2n6c、C20:5n3 (EPA)与体长呈负相关, DHA/EPA与体长呈正相关, 表明随着体长增大, 小黄鱼植物食性降低, 肉食食性增加, 营养级上升。棘头梅童鱼C18:2n6c与体长呈负相关, 表明随着体长增大, 其植物食性下降, 其他指征结果并不明确, 因此鱼类食性研究还需要结合多种方法才能更加准确。
根据聚类分析结果发现, 小黄鱼和棘头梅童鱼脂肪酸含量分别在体长60 mm和70 mm时发生显著转变, Lukoschek等[27]发现鱼类食性随体长变化, 既可以扩大捕食范围, 也能满足不同阶段营养需要, 对鱼类生长繁殖具有积极作用。不同体长组脂肪酸含量显著性差异分析及多重比较结果表明, 小黄鱼体内指示硅藻的C20:5n3 (EPA)在体长 < 70 mm和≥70 mm时具有显著差异, 且EPA与体长呈负相关, 因此推测小黄鱼达到70 mm时, 对硅藻的摄食显著降低, 指示大型藻类、海草和陆源植物食性的C18:2n6c在体长 < 120 mm和≥120 mm时存在显著差异, 且C18:2n6c与体长呈负相关, 因此推测小黄鱼超过120 mm后转变为较高营养级肉食性鱼类, 此结果与魏秀锦等[28]利用胃含物发现, 小黄鱼在体长120 mm时转变为鱼食性相吻合; 棘头梅童鱼指示大型藻类、海草和陆源植物食性的C18:2n6c在体长 < 70 mm和≥100 mm具有显著差异, 且C18:2n6c与体长呈负相关, 因此推测它在体长 < 70 mm时植物食性较高, 在70~100 mm时植物食性减少, 而体长超过100 mm时肉食性较高, 指示浮游动物食性的C20:1在体长90~100 mm与体长 < 60 mm、体长≥110 mm时具显著差异, 推测在体长 < 60 mm时棘头梅童鱼对浮游动物摄食较多, 当达到90 mm时由于食性向虾类过渡, 浮游动物食性大大减小, 而超过110 mm时不再摄食浮游动物, 转变为部分鱼类食性, 此结论与贺舟挺等[29]、王建锋等[30]对棘头梅童鱼胃含物分析结果大致吻合, 出现的部分偏差可能是由于不同地区鱼类摄食生态差异且随着过度捕捞, 为适应环境, 鱼类个体小型化、提前性成熟、摄食形态特征改变等[31]。综上, 两种石首鱼科鱼类小黄鱼和棘头梅童鱼在摄食上存在较高的相似性, 都是随着体长增大, 植物食性逐渐减小, 肉食食性逐渐增加且食性转变时的体长组也较为相近, 由此推测它们存在一定的生态位重合和食物竞争。
脂肪酸对于食性的指示具有间接性而不能直接指示饵料生物, 特别是对浮游植物的指示, 是直接摄食还是由摄食浮游动物间接获取都不得而知, 且传统胃含物分析法对浮游动植物等微小生物的鉴定十分困难, 因此在未来的研究中, 我们还需要结合胃含物DNA技术和肠道微生物等方法来完善小黄鱼和棘头梅童鱼摄食生态学研究。
| [1] |
Xue Y, Jin X S, Zhang B, et al. Diet composition and seasonal variation in feeding habits of small yellow croaker Pseudosciaena polyactis Bleeker in the central Yellow Sea[J]. Journal of Fishery Sciences of China, 2004, 11(3): 237-243. [薛莹, 金显仕, 张波, 等. 黄海中部小黄鱼的食物组成和摄食习性的季节变化[J]. 中国水产科学, 2004, 11(3): 237-243. DOI:10.3321/j.issn:1005-8737.2004.03.011] |
| [2] |
Wang S D H, Zhan B Y. Marine fishery resource management in PR China[J]. Marine Policy, 1992, 16(3): 197-209. |
| [3] |
Xu J, Wang C, Xu Z L, et al. On the seasonal quantitative changes of the fish resources in the south area of northern Jiangsu shoal[J]. Journal of Shanghai Ocean University, 2014, 23(1): 108-116. [徐捷, 王晨, 徐兆礼, 等. 苏北浅滩南部海域鱼类资源密度季节变化特征[J]. 上海海洋大学学报, 2014, 23(1): 108-116.] |
| [4] |
Xu J, Sun Y, Xu Z L. Fish assembles in the coastal water of Lüsi fishing ground during spring and summer[J]. Chinese Journal of Applied Ecology, 2014, 25(1): 243-250. [徐捷, 孙岳, 徐兆礼. 吕泗渔场沿岸海域春夏季鱼类生态类群[J]. 应用生态学报, 2014, 25(1): 243-250.] |
| [5] |
Zhong X M, Zhang H, Tang J H, et al. Temporal and spatial distribution of Larimichthys polyactis Bleeker resources in offshore areas of Jiangsu Province[J]. Journal of Fisheries of China, 2011, 35(2): 238-246. [仲霞铭, 张虎, 汤建华, 等. 江苏近岸海域小黄鱼时空分布特征[J]. 水产学报, 2011, 35(2): 238-246.] |
| [6] |
Xiong Y, Liu H B, Liu P T, et al. Reconstructing habitat history of Larimichthys polyactis in Lüsi coastal waters of Jiangsu Province, China based on otolith microchemistry[J]. Chinese Journal of Applied Ecology, 2014, 25(3): 836-842. [熊瑛, 刘洪波, 刘培廷, 等. 基于耳石元素微化学的江苏吕泗近岸小黄鱼生境履历重建[J]. 应用生态学报, 2014, 25(3): 836-842.] |
| [7] |
Iverson S J, Field C, Don Bowen W, et al. Quantitative fatty acid signature analysis:A new method of estimating predator diets[J]. Ecological Monographs, 2004, 74(2): 211-235. DOI:10.1890/02-4105 |
| [8] |
Folch J, Lees M, Sloane Stanley G H. A simple method for the isolation and purification of total lipides from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226: 497-509. |
| [9] |
Standardization Administration. Animal and vegetable fats and oils-preparation of methyl esters of fatty acids: GB/T 17376-2008[S]. Beijing: Standards Press of China, 2009: 7-8. [中国国家标准化管理委员会.动植物油脂脂肪酸甲酯制备: GB/T 17376-2008[S].北京: 中国标准出版社, 2009: 7-8.]
|
| [10] |
Jin X. Plankton food web analysis of the East China Sea and the Yellow Sea using analyses of fatty acids and stable isotopes[D]. Beijing: Graduate School of Chinese Academy of Sciences, 2011. [金鑫.黄东海浮游食物网的初步研究——基于脂肪酸标记法和碳氮稳定同位素比值法[D].北京: 中国科学院研究生院, 2011.]
|
| [11] |
Budge S M, Parrish C C, McKenzie C H. Fatty acid composition of phytoplankton, settling particulate matter and sediments at a sheltered bivalve aquaculture site[J]. Marine Chemistry, 2001, 76(4): 285-303. DOI:10.1016/S0304-4203(01)00068-8 |
| [12] |
Every S L, Pethybridge H R, Crook D A, et al. Comparison of fin and muscle tissues for analysis of signature fatty acids in tropical euryhaline sharks[J]. Journal of Experimental Marine Biology and Ecology, 2016, 479: 46-53. DOI:10.1016/j.jembe.2016.02.011 |
| [13] |
Dalsgaard J, St John M, Kattner G, et al. Fatty acid trophic markers in the pelagic marine environment[J]. Advances in Marine Biology, 2003, 46: 225-340. DOI:10.1016/S0065-2881(03)46005-7 |
| [14] |
Stowasser G, Pond D W, Collins M A. Using fatty acid analysis to elucidate the feeding habits of Southern Ocean mesopelagic fish[J]. Marine Biology, 2009, 156: 2289-2302. DOI:10.1007/s00227-009-1256-4 |
| [15] |
Rajendran N, Suwa Y, Urushigawa Y. Distribution of phospholipid ester-linked fatty acid biomarkers for bacteria in the sediment of Ise Bay, Japan[J]. Marine Chemistry, 1993, 42(1): 39-56. DOI:10.1016/0304-4203(93)90248-M |
| [16] |
Richoux N B, Deibel D, Thompson R J, et al. Seasonal and developmental variation in the fatty acid composition of Mysis mixta (Mysidacea) and Acanthostepheia malmgreni (Amphipoda) from the hyperbenthos of a cold-ocean environment (Conception Bay, Newfoundland)[J]. Journal of Plankton Research, 2005, 27(8): 719-733. DOI:10.1093/plankt/fbi045 |
| [17] |
Kattner G, Hagen W, Graeve M, et al. Exceptional lipids and fatty acids in the pteropod Clione limacina (Gastropoda) from both polar oceans[J]. Marine Chemistry, 1998, 61(3-4): 219-228. DOI:10.1016/S0304-4203(98)00013-9 |
| [18] |
Johns R B, Nichols P D, Perry G J. Fatty acid composition of ten marine algae from Australian waters[J]. Phytochemistry, 1979, 18(5): 799-802. DOI:10.1016/0031-9422(79)80018-7 |
| [19] |
Rossi S, Youngbluth M J, Jacoby C A, et al. Fatty acid trophic markers and trophic links among seston, crustacean zooplankton and the siphonophore Nanomia cara in Georges Basin and Oceanographer Canyon (NW Atlantic)[J]. Scientia Marina, 2008, 72(2): 403-416. |
| [20] |
Ospina E J C, Sierra C A, Ochoa O, et al. Substitution of saturated fat in processed meat products:A review[J]. Critical Reviews in Food Science and Nutrition, 2012, 52(2): 113-122. |
| [21] |
Simopoulos A P. Omega-3 fatty acids in inflammation and autoimmune diseases[J]. Journal of the American College of Nutrition, 2002, 21(6): 495-505. DOI:10.1080/07315724.2002.10719248 |
| [22] |
Huynh M D, Kitts D D. Evaluating nutritional quality of Pacific fish species from fatty acid signatures[J]. Food Chemistry, 2009, 114(3): 912-918. |
| [23] |
Fan Y W, Deng Z Y, Zhang A F, et al. Comparison of fatty acids in wild freshwater fish of the Poyang Lake[J]. Food Science, 2006, 27(12): 597-600. [范亚苇, 邓泽元, 张爱芳, 等. 鄱阳湖野生鱼类脂肪酸含量的比较研究[J]. 食品科学, 2006, 27(12): 597-600. DOI:10.3321/j.issn:1002-6630.2006.12.150] |
| [24] |
Middelburg J J, Herman P M J. Organic matter processing in tidal estuaries[J]. Marine Chemistry, 2007, 106(1-2): 127-147. DOI:10.1016/j.marchem.2006.02.007 |
| [25] |
Wang K, Zhang S Y, Wang Z H, et al. Feeding habits of small yellow croaker Larimichthys polyactis off Ma'an archipelago[J]. Acta Hydrobiologica Sinica, 2012, 36(6): 1188-1192. [王凯, 章守宇, 汪振华, 等. 马鞍列岛海域小黄鱼的食性[J]. 水生生物学报, 2012, 36(6): 1188-1192.] |
| [26] |
Liu M T, Li C L, Sun S, et al. Fatty acid composition of Calanus sinicus in autumn in Yellow Sea and its implications[J]. Oceanologia et Limnologia Sinica, 2013, 44(3): 702-708. [刘梦坛, 李超伦, 孙松, 等. 秋季黄海中华哲水蚤(Calanus sinicus)脂肪酸组成及其指示作用[J]. 海洋与湖沼, 2013, 44(3): 702-708.] |
| [27] |
Lukoschek V, McCormick M I. Ontogeny of diet changes in a tropical benthic carnivorous fish, Parupeneus barberinus (Mullidae):Relationship between foraging behaviour, habitat use, jaw size, and prey selection[J]. Marine Biology, 2001, 138(6): 1099-1113. DOI:10.1007/s002270000530 |
| [28] |
Wei X J, Zhang B, Shan X J, et al. Feeding habits of small yellow croaker Larimichthys polyactis in the Bohai Sea[J]. Journal of Fishery Sciences of China, 2018, 25(6): 1289-1298. [魏秀锦, 张波, 单秀娟, 等. 渤海小黄鱼摄食习性[J]. 中国水产科学, 2018, 25(6): 1289-1298.] |
| [29] |
He Z T, Zhang Y Z, Xue L J, et al. Seasonal and ontogenetic diet composition variation of Collichthys lucidus in inshore waters in the north of East China Sea[J]. Marine Fisheries, 2012, 34(3): 270-276. [贺舟挺, 张亚洲, 薛利建, 等. 东海北部近海棘头梅童鱼食物组成的季节变化及随发育的变化[J]. 海洋渔业, 2012, 34(3): 270-276. DOI:10.3969/j.issn.1004-2490.2012.03.005] |
| [30] |
Wang J F, Zhao F, Song C, et al. Diet composition and seasonal variation in feeding habits of Collichthy lucidus in Yangtze Estuary, China[J]. Chinese Journal of Applied Ecology, 2016, 27(1): 291-298. [王建锋, 赵峰, 宋超, 等. 长江口棘头梅童鱼食物组成和摄食习性的季节变化[J]. 应用生态学报, 2016, 27(1): 291-298.] |
| [31] |
Guo B, Zhang B, Jin X S. Diet composition and ontogenetic variation in feeding habits of juvenile small yellow croaker Pseudosciaena polyactis Bleeker in the Yellow Sea[J]. Journal of Fishery Sciences of China, 2010, 17(2): 289-297. [郭斌, 张波, 金显仕. 黄海海州湾小黄鱼幼鱼的食性及其随体长的变化[J]. 中国水产科学, 2010, 17(2): 289-297.] |
 2020, Vol. 27
2020, Vol. 27

