2. 设施渔业教育部重点实验室, 辽宁 大连 116023
2. Key Laboratory of Environment Controlled Aquaculture, Ministry of Education, Dalian 116023, China
在鱼类养殖生产过程中, 诸多生态因子(温度、光照、水质等)均会对其生长发育产生重要的影响, 光照作为其中一个重要且复杂的生态因子, 可直接或间接地对水产动物的摄食、生长、存活率及肌肉营养品质等多方面产生影响[1]。光照包括3个要素, 即光周期、光强和光谱, 其中光周期被认为是首要的授时因子(zeitgeber)[2]。关于光环境特别是光周期的影响, 相比于鱼类, 国内学者对家禽的研究相对较多, 如研究发现在不同的光周期下饲养的雏鸡脑中的神经肽分布显著不同, 光周期的变化改变神经肽的分布调控促性腺激素释放激素(GnRH)的分泌, 进而调节鸡的生产性能[3]。还有研究表明, 适宜的光环境可以改善肉鸡生长早期小肠黏膜形态结构的发育, 提高小肠对营养物质的吸收能力, 促进肉鸡生长发育及肌肉营养品质[4]。这表明不同的光环境对家禽生长及生理功能的影响不同。关于光周期对鱼类影响的研究还处于起步阶段, 有研究表明节律激素的合成和释放与光周期之间具有密切联系, 光周期所提供的内部同步信号会影响鱼的节律性生理功能[5]。不同物种的鱼类因其栖息环境和自身视觉功能的不同, 对光环境的需求也大有不同[6]。如合适的光周期可以提高虹鳟(Oncorhynchus mykiss)生长速率和饵料转换率[7], 但光周期改变并不会对比目鱼(Hippoglossus hippoglossus)的生长产生显著影响[8]。因此, 光周期对生物的影响具有种属特异性。合理的光周期会促进鱼类的生长发育, 提高饵料转化率, 并优化鱼类生理功能过程, 增强营养物质的吸收进而提升肌肉营养品质。目前, 国内外学者关于鱼类肌肉营养品质的研究日益增多, 且多集中在摄食成分对鱼类肌肉营养成分影响等方面。如有研究比较鱼类在野生与人工养殖条件下的肌肉营养成分[9-11], 还有研究关注中草药成分的添加对草鱼(Ctenopharyngodon idellus)肌肉营养成分的影响[12]及不同种成分的人工饲料对鱼类肌肉中脂质及氨基酸含量的影响[13-14]等。但目前有关环境生态因子对鱼类肌肉营养品质影响的研究报道较少。
欧洲舌齿鲈(Dicentrarchus labrax)隶属鲈形目(Perciformes), 狼鲈科(Moronidae), 舌齿鲈属, 又名欧鲈, 是欧洲首个商业化养殖的非鲑科海水鱼类, 较适合工厂化养殖, 即使在地中海地区多样化的商业养殖鱼类中, 仍能占据重要地位[15]。欧洲舌齿鲈个体大, 富含人体所必需的不饱和脂肪酸和微量元素, 受到消费者的认可和青睐, 数十年间由于较高的市场需求量和特有的芳香品质使其价格不断上涨[16], 随着中国引进欧洲舌齿鲈及其人工繁育技术的突破, 欧洲舌齿鲈在中国的养殖规模也越来越大[9], 但现阶段的工厂化养殖条件较为粗放, 对光照环境的调控没有统一标准, 因此适宜欧洲舌齿鲈养殖的光周期条件研究变得尤为重要。
目前, 有关光周期对欧洲舌齿鲈生长的影响研究多集中在其形态学生长及发育的变化。如有研究表明, 较长时长的光照(16L : 8D)对雄性欧洲舌齿鲈的生长具有一定的促进作用[17]; 但也有学者发现持续光照虽然可以促进欧洲舌齿鲈的生长, 却不能保证鱼类的正常发育[18]。而国内外还未见有光周期对欧洲舌齿鲈肌肉营养品质的影响研究。故针对上述问题, 本研究在人工养殖条件下, 探讨不同LED光周期(0L : 24D、8L : 16D、12L : 12D、16L : 8D、24L : 0D)对欧洲舌齿鲈幼鱼生长摄食和肌肉营养成分的影响, 以期为我国欧洲舌齿鲈工厂化养殖光环境的调控提供参考依据。
1 材料与方法 1.1 实验用鱼实验所用欧洲舌齿鲈幼鱼购自大连富谷食品有限公司。选取450尾无外伤、体质健康的幼鱼[体长(13.50±0.52) cm, 体重(46.04±0.61) g]作为实验用鱼, 并将其放入实验室搭建的小型循环水系统中进行为期1周的暂养, 以保证其对新环境的适应。养殖期间采用浮性商业饲料(广东粤海饲料集团生产)进行投喂, 每天投喂两次, 投喂时间为9:00和14:30。
1.2 实验设计实验在大连海洋大学设施渔业教育部重点实验室所搭建的密闭遮光系统中进行。遮光系统采用不透光材质遮光布在养殖池内搭建而成, 每个养殖池内设置4个独立的房间, 尽量保证房间之间无光源的交叉污染。每房间内均设置有1个LED光源、3个PVC水族桶。实验光源为全光谱LED灯具(型号GK5A), 波长范围为400~780 nm, 由中国科学院半导体研究所设计, 深圳超频三科技股份有限公司生产制造。光源安装在水族桶上方1.5 m处。PVC水族桶为圆柱形灰白色, 直径80 cm, 桶深60 cm。5种光周期处理组分别为0L : 24D (全黑暗)、8L : 16D、12L : 12D、16L : 8D、24L : 0D (全光照), 其中L表示光照时间, D表示黑暗时间。实验开始时, 将实验鱼随机均等地分配至各处理组中, 每个处理组内3个重复, 每个重复放置30尾鱼, 实验周期为60 d。
不同光周期条件由电子定时器进行调控, 除全黑暗组外其余实验组的光照度范围设定为(250±20) mW/m2。实验期间, 每天8:00进行光照度的监测, 采用光谱照度计(SRI 2000UV, 尚泽光电股份有限公司, 中国台湾)在每个水族桶的水面位置进行测量; 每天投喂两次(9:00和14:30), 总投喂量为鱼体总重量的2%;水温设定为(19±1) ℃并采用控温加热棒调控; 水族桶内的水每2天更换1次, 换水体积为50%, 更换时对桶底部的残饵粪便进行清除。
1.3 样品采集残饵收集在投喂1 h后进行, 将收集的残饵随即放入75 ℃烘箱烘干至恒重。为了准确计算实验用鱼的摄食量, 实验结束时, 将定量饲料浸泡于养殖海水中, 1 h后收集进行烘干至恒重, 记录实际重量, 计算饵料在水中浸泡1 h的溶失系数。
实验开始前, 随机抽取10尾鱼作为初始样品, 测量和记录其体长体重作为参照。实验结束时, 采用随机取样的方式从每个水族桶选取3尾鱼进行麻醉处理, 先进行体长体重的测量, 随后在冰盒上迅速解剖, 取鱼体背部两侧肌肉, 去鳞、去皮, 用去离子水进行冲洗干净后, 放置于–80 ℃超低温冰箱中保存, 用于后续样品的测定。
1.4 指标测定及计算方法 1.4.1 生长性能测定根据下列公式进行增重率(WGR)、肥满度(K)、肝体系数(HSI)、日增重系数(DGI)、体长特定生长率(SGRL)、体重特定生长率(SGRW)的计算。
增重率(WGR)=(W2–W1)/W1×100%;
肥满度(K)=(W2/L23)×100%;
肝体系数(HSI)=100×(H/W2);
日增重系数(DGI)=100×[(W21/3–W11/3)/T2–T1];
体长特定生长率(SGRL)=100×(lnL2–lnL1)/ (T2–T1);
体重特定生长率(SGRW)=100×(lnW2–lnW1)/ (T2–T1)。
式中, W1为实验开始时鱼体重(g); W2为实验结束时鱼体重(g); L1为实验开始时鱼体长(g); L2为实验结束时鱼体长(g); T1为实验开始时间; T2为实验结束时间; H为鱼体肝脏重量;
1.4.2 摄食指标测定根据以下公式进行摄食率(FRW)、饵料系数(FCR)和饵料转化系效率(FCEW)的计算。
摄食率(FRW)=100×F/[(W2+W1)/2]/(T2–T1);
饵料系数(FCR)= F/(W2–W1);
饵料转换效率(FCEW, %)= 100×(W2–W1)/F。
式中, W1、W2、T1、T2含义同1.4.1; F为实验阶段内鱼的总进食量。
1.4.3 常规营养成分测定水分测定参照GB 5009.3—2016采用105 ℃干燥法; 粗蛋白含量参照GB 5009.5—2016采用凯氏定氮法, 利用K9860凯氏定氮仪完成测定; 粗脂肪含量参照GB 5009.168—2016采用索氏抽提法, 利用YG-2型脂肪抽提器完成测定。粗灰分含量参照GB 5009.3—2016采用马弗炉550 ℃灼烧法完成测定。
1.4.4 组织脂肪酸测定将冷冻的肌肉样品干燥至恒重, 然后采用型号为Agilent 7890A气相色谱仪进行脂肪酸组成的测定, 样品中各脂肪酸的含量按下列公式进行计算:
| $ W = \frac{{C \times V \times N}}{m} \times k $ |
式中, W为样品中各脂肪酸的含量, mg/kg; C为样品测定液中脂肪酸甲酯的浓度, mg/L; V为定容体积, mL; k为各脂肪酸甲酯转化为脂肪酸的换算系数; N为稀释倍数; m为样品的称样质量, g。
1.4.5 氨基酸测定食品中氨基酸的测定采用Agilent 1260高效液相色谱仪, 色谱柱: C18 SHISEIDO 4.6 mm×250 mm×5 μm, 进样量: 10 μL, 柱温: 40 ℃, 波长: 254 nm, 流动相: A: 0.1 mol/L无水乙酸钠+乙腈=97+3, 混匀后调pH至6.5 (31.815 g乙酸钠+3880 mL水+120 mL乙腈); B:乙腈+水=80+20。
1.4.6 羟脯氨酸浓度及胶原蛋白含量测定每处理组各取3份肌肉样品用于该测定, 每份30~ 100 mg。羟脯氨酸浓度的测定参照南京建成试剂盒说明书进行。测定原理为羟脯氨酸在氧化剂的作用下, 所产生的氧化产物与二甲基苯甲醛作用呈现紫红色, 根据不同深浅程度的颜色在550 nm处的吸光值, 计算出羟脯氨酸的含量。
由于羟脯氨酸含量稳定, 在其他蛋白中很少见, 为胶原蛋白所特有, 水产动物多采用11.1的换算系数将羟脯氨酸换算为胶原蛋白含量[19]。
1.5 肌肉营养价值评价根据1973年联合国粮农组织/世界卫生组织(FAO/WHO)和1991年中国预防医学科学院营养与食品卫生研究所提出的评价标准, 即氨基酸评分标准模式和全鸡蛋蛋白质氨基酸模式, 将样品中某必需氨基酸的质量分数换算成每克蛋白质中含氨基酸毫克数, 计算出氨基酸评分(AAS)和化学评分(CS), 以及必需氨基酸指数(EAAI), 具体公式如下:
aa = (样品中该氨基酸质量分数/样品中粗蛋白质质量分数)×6.25×1000。
AAS = aa/AA(FAO/WHO)
CS = aa/AA (egg)
| $ {\rm{EAAI}} = {{\rm{(100A/AE}} \times 100{\rm{B/BE}} \times 100{\rm{C/CE}} \times \ldots \times {\rm{100H/HE)}}^{\frac{1}{n}}} $ |
式中, aa为检测样品中某种氨基酸含量(mg/g), AA(FAO/WHO)为氨基酸评价标准含量(mg/g), AA(egg)为全鸡蛋蛋白质中同种氨基酸含量(mg/g), n代表比较的必需氨基酸个数, A, B, C, ……, H分别为鱼肌肉蛋白质中某种必需氨基酸含量(mg/g), AE, BE, CE, ……, IE分别代表全鸡蛋蛋白质中各类必需氨基酸含量(mg/g)。
1.6 数据统计分析实验数据采用SPSS 24.0进行单因素方差分析(one-way ANOVA), 并利用Duncan多重比较分析不同处理组之间的差异; 以0.05作为差异显著水平。所有数据采用平均值±标准差(x±SD)表示, 并采用Origin 2017软件进行绘图。
2 结果与分析 2.1 生长性能5种光周期下欧洲舌齿鲈幼鱼的生长性能指标如表 1所示。其中0L : 24D处理组的肥满度显著低于16L : 8D处理组(P < 0.05), 而与其他各组均无显著性差异(P>0.05)。所有处理组的肝体指数均无显著差异。24L : 0D处理组的体长特定生长率显著低于8L : 16D和12L : 12D处理组(P < 0.05), 而与0L : 24D与16L : 8D处理组无显著性差异(P>0.05)。8L : 16D处理组的体重特定生长率显著高于其他各组(P < 0.05), 与16L : 8D处理组无显著性差异(P>0.05), 24L : 0D处理组的体重特定生长率显著低于其他各组(P < 0.05)。8L : 16D处理组的日增重系数均高于其他各组。0L : 24D和24L : 0D处理组的日增重系数显著低于其他各组。
|
|
表 1 不同光周期下欧洲舌齿鲈幼鱼的生长指标 Tab.1 Growth indices of juvenile Dicentrarchus labrax under different photoperiods |
5种光周期下欧洲舌齿鲈幼鱼的体长体重及增重率指标如图 1所示。24L : 0D处理组体长显著低于8L : 16D和12L : 12D处理组(P < 0.05), 而与0L : 24D和16L : 8D处理组之间无显著性差异(P>0.05)。8L : 16D组的体重显著高于其他各组, 0L : 24D与24L : 0D处理组显著低于12L : 12D和16L : 8D处理组(P < 0.05)。增重率方面, 8L : 16D处理组显著高于其他各组(P < 0.05), 24L : 0D处理组的增重率最低。

|
图 1 不同光周期下欧洲舌齿鲈幼鱼的生长指标同一生长指标中不同字母表示不同处理组间差异显著(P < 0.05). Fig.1 Growth indices of juvenile Dicentrarchus labrax under different photoperiods In the same growth index, different letters mean significant differences between different treatment groups (P < 0.05). |
5种光周期下欧洲舌齿鲈幼鱼的摄食相关指标如表 2所示, 0L : 24D处理组和24L : 0D处理组的饵料系数显著高于其余三组(P < 0.05), 而8L : 16D、12L : 12D和16L : 8D处理组之间没有显著差异(P>0.05), 8L : 16D处理组饵料系数最低。各实验组的摄食率没有显著差异(P> 0.05), 但24L : 0D处理组的摄食率略高于其他各组。8L : 16D处理组的饵料转换系数最高, 并显著高于0L : 24D处理组和24L : 0D处理组(P < 0.05), 与12L : 12D和16L : 8D处理组之间没有显著差异, 而24L : 0D处理组中的饵料转换效率最低。
|
|
表 2 不同光周期下欧洲舌齿鲈幼鱼的摄食情况 Tab.2 Feeding of juvenile Dicentrarchus labrax under different photoperiods |
5种光周期下欧洲舌齿鲈幼鱼肌肉中的常规营养成分(水分、粗蛋白、粗脂肪、粗灰分)如表 3所示。各处理组欧鲈幼鱼肌肉中的水分、粗蛋白和粗灰分含量均无显著差异(P>0.05), 但8L : 16D组的粗蛋白和粗灰分含量均略高于其他各组; 8L : 16D组的粗脂肪含量最高, 16L : 8D组粗脂肪含量显著低于8L : 16D和0L : 24D处理组(Pcenter0.05), 而与12L : 12D和24L : 0D组之间无显著差异(P>0.05)。
|
|
表 3 不同光周期条件下欧洲舌齿鲈幼鱼的常规营养成分含量 Tab.3 Common nutritional component contents of juvenile Dicentrarchus labrax under different photoperiods |
5种不同光周期处理组欧鲈肌肉样品中羟脯氨酸的含量分别为0.03% (0L : 24D)、0.05% (8L : 16D)、0.04% (12L : 12D)、0.05% (16L : 8D)、0.03% (24L : 0D)(图 2a); 其对应的胶原蛋白含量分别为0.32% (0L : 24D)、0.59% (8L : 16D)、0.48% (12L : 12D)、0.60% (16L : 8D)、0.31% (24L : 0D) (图 2b)。24L : 0D组中肌肉胶原蛋白含量最低, 而0L : 24D和24L : 0D组之间无显著差异(P> 0.05), 且两个处理组的胶原蛋白含量显著低于其他各组(P < 0.05); 8L : 16D、12L : 12D和16L : 8D处理组之间胶原蛋白含量无显著差异(P>0.05)。
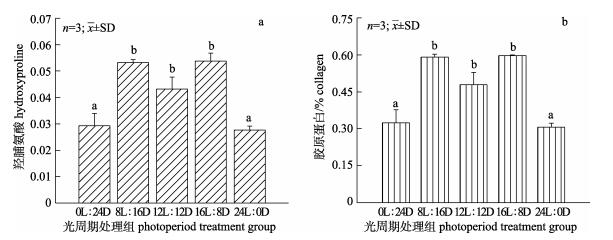
|
图 2 不同光周期条件下欧洲舌齿鲈幼鱼肌肉中羟脯氨酸(a)和胶原蛋白(b)含量不同小写字母表示各光周期处理组间差异显著(P < 0.05). Fig.2 Hydroxyproline (a) and collagen (b) content in muscle of juvenile Dicentrarchus labrax under different photoperiods Different letter superscripts mean significant differences between different photoperiod treatment groups (P < 0.05). |
5种光周期下欧洲舌齿鲈幼鱼肌肉中的氨基酸组成及含量如表 4所示。所有处理组的肌肉样品中均检测到17种氨基酸(不包含色氨酸), 包括7种人体必需氨基酸、3种半必需氨基酸以及7种非必需氨基酸。其中, 8L : 16D、12L : 12D和16L : 8D处理组肌肉中氨基酸总质量分数没有显著差异(P>0.05), 分别为(19.06±1.69)%、(18.64±0.47)%和(19.86±0.71)%, 而0L : 24D和24L : 0D处理组的氨基酸总质量分数显著低于上述3组(P < 0.05), 分别为(17.08± 0.55)%和(17.37±0.17)%。
|
|
表 4 不同光周期条件下欧洲舌齿鲈肌肉氨基酸组成 Tab.4 Amino acid composition in muscle of juvenile Dicentrarchus labrax under different photoperiods |
呈鲜味氨基酸组成中, 谷氨酸在各组中所占质量分数均高于其他呈鲜味氨基酸。天冬氨酸在16L : 8D组中所占质量分数最高, 显著高于8L : 16D和24L : 0D处理组(P < 0.05), 24L : 0D组中天冬氨酸质量分数最低, 但与8L : 16D组没有显著性差异; 半必需氨基酸组成中精氨酸的质量分数均比其他种半必需氨基酸高。其中, 12L : 12D组精氨酸质量分数最高, 显著高于24L : 0D组, 但与0L : 24D、8L : 16D和16L : 8D组没有显著性差异。24L : 0D组中组氨酸质量分数最低, 显著低于其他各组(P < 0.05), 而其余各组间均无显著性差异; 非必需氨基酸组成中, 脯氨酸的质量分数高于其他种非必需氨基酸; 其中, 0L : 24D组中的脯氨酸质量分数最低, 显著低于16L : 8D组(P < 0.05), 而16L : 8D组中脯氨酸质量分数略高于8L : 16D、12L : 12D以及24L : 0D组, 但均无显著性差异。
总之, 7种必需氨基酸(苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸)、2种呈鲜味氨基酸(甘氨酸、丙氨酸)以及1种非必需氨基酸(酪氨酸)在5种光周期条件下均无显著差异(P>0.05)。
2.5.2 肌肉营养品质评价由表 5可知, 5种光周期处理组中的苏氨酸和苯丙氨酸+酪氨酸评分均高于FAO/WHO氨基酸模式, 且赖氨酸含量均高于FAO/WHO氨基酸模式和全鸡蛋蛋白模式评价标准; 在12L : 12D处理组中, 缬氨酸、蛋氨酸+半胱氨酸、亮氨酸以及异亮氨酸含量均接近或者高于FAO/WHO氨基酸模式, 所含必需氨基酸总量也高于FAO/WHO氨基酸模式下的总量; 同时该处理组中必需氨基酸总量高于其他处理组。8L : 16D处理组中所检测到的各类必需氨基酸的评分均低于其他各组, 其中蛋氨酸+胱氨酸和亮氨酸评分最低。
|
|
表 5 不同光周期条件下欧洲舌齿鲈肌肉中必需氨基酸含量与FAO/WHO和鸡蛋蛋白模式比较 Tab.5 Comparison of essential amino acid contents in muscle of juvenile Dicentrarchus labrax under different photoperiods with FAO /WHO amino acid pattern and whole egg protein amino acid pattern |
由表 6可知, 5种处理组中必需氨基酸的氨基酸评分除8L : 16D组中的蛋氨酸+胱氨酸外, 均在80分以上, 化学评分除8L : 16D和24L : 0D组中蛋氨酸+胱氨酸外, 均高于50分。此外, 在0L : 24D和12L : 12D处理组中, 第一限制性氨基酸均为缬氨酸, 而在8L : 16D、16L : 8D和24L : 0D中, 第一限制性氨基酸均为蛋氨酸+胱氨酸。
|
|
表 6 不同光周期条件下欧洲舌齿鲈肌肉中必需氨基酸氨基酸评分(AAS)、化学评分(CS)和必需氨基酸指数(EAAI)比较 Tab.6 Comparison of AAS, CS and EAAI of essential amino acid in muscle of juvenile Dicentrarchus labrax under different photoperiods |
各组光周期条件下欧洲舌齿鲈肌肉脂肪酸的组成如表 7所示。各处理组中肌肉脂肪酸组成中, 除16L : 8D和24L : 0D组没有检测到顺-8, 11, 14二十碳三烯酸外, 其余各组脂肪酸组成均一致。共检测到25种脂肪酸, 包括9种饱和脂肪酸、6种单不饱和脂肪酸以及10种多不饱和脂肪酸。
|
|
表 7 不同光周期条件下欧洲舌齿鲈肌肉脂肪酸组成 Tab.7 Fatty acid composition in muscle of juvenile Dicentrarchus labrax under different photoperiods |
在饱和脂肪酸(SFA)方面, 5种光周期处理组肌肉中的SFA总含量有明显差异, 其中8L : 16D、12L : 12D以及16L : 8D组显著高于0L : 24D和24L : 0D组(P < 0.05), 24L : 0D组中肌肉SFA含量在5种处理组中最低。所有处理组中的棕榈酸(C16 : 0)含量均高于其他种SFA, 且8L : 16D组中C16 : 0含量显著高于24L : 0D (P < 0.05), 并略高于其他各组, 而24L : 0D组中棕榈酸含量最低; 在单不饱和脂肪酸(MUFA)方面, MUFA总含量在5个处理组中没有显著性差异, 但是反油酸甲酯(C18 : 1n9c)含量均在24L : 0L组中最低, 显著低于0L : 24D和8L : 16D组(P < 0.05)。24L : 0D组中二十碳烯酸甲酯(C20 : 1)含量最低, 但是与其他各组没有显著性差异; 多不饱和脂肪酸(PUFA)总含量在各处理组间差异显著, 其中, 0L : 24D组中PUFA总含量最低, 显著低于24L : 0D组, 但与其他3组差异不显著。EPA(C20 : 5n3)和DHA(C22 : 6n3)含量在各处理组中没有显著性差异。
3 讨论 3.1 不同光周期对欧洲舌齿鲈幼鱼生长和摄食性能的影响光周期对鱼类早期生长发育的影响已有许多报道, 结果均表明适宜的光周期对鱼类早期生长发育有促进作用[20]; 如大西洋鲑(Salmo salar), 无论是淡水生活阶段, 还是处于变态过程的幼鲑阶段, 抑或后期海水生活阶段, 均会对光周期非常敏感[6]。本研究结果表明, 0L : 24D和24L : 0D处理组的欧洲舌齿鲈幼鱼的最终体重显著低于其他各组, 这表明持续光照或者黑暗条件均不适于欧洲舌齿鲈幼鱼[(13.50±0.52) cm]的生长。而Villamizar等[20]的研究表明, 5日龄的欧洲舌齿鲈仔鱼在持续光照条件下生长较其他光周期条件快, 并且在9日龄时就完全消耗了卵黄囊。由此表明, 同种鱼类的不同生长阶段所需的光周期条件也不同。如Barlow等[21]在尖吻鲈(Lates calcarifer)的研究中发现, 持续光照条件下鱼的摄食率提高, 但生长速率没有显著提高。本研究中, 不同光周期下的欧洲舌齿鲈幼鱼的摄食率没有明显差异, 但0L : 24D和24L : 0D组的饵料转换系数较其他各组偏低, 这与Biswas等[22]发现真鲷(Pagrus major)在光周期24L : 0D条件下的摄食率和饵料转化效率显著高于16L : 8D等其他各组的研究结果相反。有研究表明饵料转化效率与细胞代谢二者之间的相关性非常高, 细胞代谢速率升高会导致饵料转化效率提升[23]。Keembiyehetty等[24]发现当周围环境因子最适时, 幼鱼的代谢速率和饵料中营养物质的利用率也会大幅度提升。本研究中0L : 24D和24L : 0D两组中饵料转化效率显著低于其他处理组, 可能的原因是持续光照或者黑暗等不适宜的环境因子减慢了欧洲舌齿鲈幼鱼的细胞代谢率, 导致饵料转化效率以及营养物质的利用率降低, 最终影响了体重的增加, 具体的调控机理还有待进一步研究。
3.2 不同光周期对欧洲舌齿鲈幼鱼肌肉常规营养成分的影响肌肉是鱼类重要的营养部位, 也是最主要的食用部位, 而粗蛋白、粗脂肪以及其他营养成分的组成代表着鱼类的整体营养价值[9]。有研究表明, 鱼类的营养价值又主要受肌肉中蛋白质和脂肪的含量所决定[25]。本研究中, 8L : 16D组肌肉中粗蛋白含量高于其他各组, 且粗脂肪含量显著高于16L : 8D和24L : 0D两个处理组, 而0L : 24D组肌肉中粗蛋白含量最低, 这表明每日8 h的光照时长有利于欧洲舌齿鲈肌肉中常规营养成分含量的增加。有研究发现, 红光会影响欧洲舌齿鲈幼鱼肌肉中的粗脂肪含量, 这说明不适宜的光照环境可能会对欧洲舌齿鲈幼鱼产生一定程度的胁迫[26]。本研究16L : 8D和24L : 0D组中欧洲舌齿鲈幼鱼肌肉中粗脂肪含量低于其他各组, 这可能是因为长光照或者持续光照会对欧洲舌齿鲈产生一定的胁迫。8L : 16D组中肌肉粗脂肪含量最高, 说明该光照条件对欧洲舌齿鲈较适宜, 有利于肌肉中常规营养成分含量的增加。但目前光照对鱼类营养代谢的影响机制仍不清楚, 有待进一步研究。
3.3 不同光周期对欧洲舌齿鲈幼鱼肌肉胶原蛋白含量的影响胶原蛋白是一种纤维状的结构性蛋白, 目前已经发现多种形式的胶原蛋白, 根据分子结构的不同可以分为一型、二型、三型等多种类型, 而其中一型胶原蛋白是最常见也是最重要的[27]。水产及畜禽动物肌肉胶原蛋白含量的高低是判断肌肉品质的重要指标[12]。鱼类肌肉中胶原蛋白含量越高, 越能有效维持鱼类肌肉的韧性和品质[28]。本研究中, 0L : 24D和24L : 0D处理组欧洲舌齿鲈肌肉中胶原蛋白含量显著低于其他各组, 8L : 16D组中肌肉胶原蛋白含量最高, 说明8L : 16D的光周期条件可以提高鱼肌肉中胶原蛋白的含量, 提升欧洲舌齿鲈的肌肉品质。一般来说, 鱼类的一型胶原蛋白由COLLA1和COLLA2两个基因编码[29], 刘邦辉[30]研究发现草鱼肌肉中COLLA1基因含有与高等脊椎动物胶原蛋白相同的信号肽、C-前肽和三重螺旋结构; 而C-前肽是促进前胶原蛋白成熟且使其转化成三重螺旋稳定结构的胶原蛋白的关键[31]。关于本实验中0L : 24D和24L : 0D两个光周期是否可能影响欧洲舌齿鲈肌肉中COLLA1基因表达, 进而影响C-前肽发挥作用, 最终导致胶原蛋白含量降低, 还有待进一步验证。
3.4 不同光周期下对欧洲舌齿鲈幼鱼的肌肉氨基酸组成与营养价值分析鱼类肌肉中的氨基酸组成和含量决定着蛋白质的质量, 影响鱼类的生长发育过程, 同时对鱼类肌肉营养品质起着决定性作用[32]。本研究结果表明, 0L : 24D和24L : 0D处理组中总氨基酸含量低于8L : 16D、12L : 12D和16L : 8D处理组。有研究发现, 饲料中蛋白质的含量会影响鱼类肌肉中总氨基酸含量[14]。而在同等人工饲料条件喂养下, 0L : 24D组和24L : 0D组中总氨基酸含量较低可能与该两组中实验鱼饵料转换效率较低有关, 可能是营养物质利用率受到影响, 进而导致肌肉中总氨基酸含量下降。动物肌肉的鲜味与其自身的呈鲜味氨基酸含量有很大关系, 而最有特征性的呈鲜味氨基酸为天冬氨酸(Asp)和谷氨酸(Glu), 二者是肌肉呈现鲜味的主要贡献者[33]; 而甘氨酸(Gly)和丙氨酸(Ala)是呈现甘味的特征性氨基酸[34]。本研究发现12L : 12D组的Asp含量高于其他各组, 而0L : 24D组中Glu含量最低, 各个处理组中的Gly和Ala含量没有显著差异。有研究表明, 鱼类肌肉中呈鲜味氨基酸的合成是通过调节相关酶的合成进而改变三羧酸循环以及糖酵解等途径来实现[35]。12L : 12D的光周期可能有助于鱼体有关部位的相关酶合成, 进而促进了呈鲜味氨基酸的合成。
蛋白质中氨基酸组成的FAO/WHO理想模式应该是:必需氨基酸/总氨基酸的值约为40%, 必需氨基酸/非必需氨基酸应在60%以上[34]。本研究发现5种光照周期处理组中肌肉必需氨基酸/总氨基酸为39%左右, 必需氨基酸/非必需氨基酸为85%左右, 均接近或者明显超过理想模式评分, 由此证明欧洲舌齿鲈的肌肉中优质蛋白质含量丰富。必需氨基酸指数(EAAI)作为评价蛋白质营养价值的指标之一, 值的高低代表着氨基酸组成的平衡性以及蛋白质的质量[25]。本研究中12L : 12D处理组中EAAI最高, 为83.56。由此可见, 在氨基酸组成方面, 12L : 12D的光照周期条件下的欧洲舌齿鲈的肌肉蛋白质更优质更符合标准。
3.5 不同光周期下欧洲舌齿鲈幼鱼的肌肉脂肪酸组成评价脂肪酸作为能源的同时更是生物体必需的脂肪源。有研究表明, 生物机体内的饱和脂肪酸组成中, 肉豆蔻酸(C14 : 0)、棕榈酸(C16 : 0)和硬脂酸(C18 : 0)的含量占绝大部分, 尤其以C16 : 0含量最高[36]。当生物机体受到外界刺激后, 体内饱和脂肪酸会进行分解应对该过程, 且C16 : 0会被优先用于能量消耗[37]。本研究中, 5种光周期处理组均呈现出C14 : 0、C16 : 0和C18 : 0含量高于其他种类饱和脂肪酸的情况。但24L : 0D组肌肉中饱和脂肪酸总含量最低, 且C16 : 0的含量最低, 其原因可能是长期的光照环境会对欧洲舌齿鲈幼鱼产生胁迫作用, 机体需消耗更多的能量应对胁迫。
鱼类肌肉中多不饱和脂肪酸(PUFA)的组成和含量是评价营养品质高低的重要指标。有研究表明, 脂肪加热后会产生香气, 同时高含量的多不饱和脂肪酸也是鱼类肌肉多汁性的物质基础[34]。本研究中, 各光照处理组中多不饱和脂肪酸占肌肉脂肪酸比例均高于36%, 且高于其他多种鱼类, 如黄斑蓝子鱼(Siganus canaliculatus) PUFA含量为28.28%[32], 光倒刺鲃(Spinibarbus hollandi) PUFA含量为11.7%[38]。有研究发现, EPA和DHA是PUFA中主要的脂肪酸类别, 也是人及动物生长过程中的必需脂肪酸[39]。同时EPA和DHA在鱼类早期发育过程中对脑、视神经及生殖器官等的发育有着重要的作用[9, 40-41]。本研究中, 8L : 16D处理组中EPA+DHA含量最高, 0L : 24D处理组中EPA+DHA含量最低, 可见8L : 16D光照环境更有利于欧洲舌齿鲈肌肉中EPA和DHA的合成和富集。而有关光周期对鱼类肌肉中脂肪酸合成影响的机制仍不明确, 有待进一步研究。
4 结论5种不同光周期对欧洲舌齿鲈幼鱼生长、摄食和肌肉营养成分均产生不同程度的影响。其中8L : 16D光周期下欧洲舌齿鲈幼鱼的日增重系数、特定生长率及相对增重率显著高于其他各组; 除粗脂肪含量外, 5种光照周期下欧洲舌齿鲈幼鱼肌肉的常规营养成分没有明显差异。8L : 16D光照环境可以不同程度的提升欧洲舌齿鲈肌肉中必需氨基酸的含量, 而12L : 12D光周期可以提高欧洲舌齿鲈肌肉中氨基酸组成的平衡性及蛋白质质量, 且EHA+DHA含量在8L : 16D处理组中较高, 因此, 8L : 16D和12L : 12D两种光周期均可在一定程度上提升鱼肉的营养品质。
致谢: 特别感谢中国科学院半导体研究所宋昌斌老师在光源设计和布置中提供的技术支持和理论指导。| [1] |
Lu S W. Effect of different diets, stocking densities and photoperiods on juvenile Epinephelus malabaricus[D]. Nanjing: Nanjing Agricultural University, 2010. [逯尚尉.不同饵料、密度和光周期对点带石斑鱼(Epinephelus malabaricus)幼鱼的影响[D].南京: 南京农业大学, 2010.]
|
| [2] |
Choe Y G, Choi J E, Roh D W, et al. Light-dark and food restriction cycles in red sea bream, Pagrus major: Effect of zeitgebers on demand-feeding rhythms[J]. Journal of Fisheries Science and Technology, 2001, 4(3): 138-143. DOI:10.1016/0031-9384(95)00116-Z |
| [3] |
Xie D, Chen Y X, Wang Z X, et al. Effects of monochromatic light on structure of small intestinal mucosa in broilers[J]. Scientia Agricultura Sinica, 2009, 42(3): 1084-1090. [谢电, 陈耀星, 王子旭, 等. 单色光对肉雏鸡小肠黏膜形态结构的影响[J]. 中国农业科学, 2009, 42(3): 1084-1090.] |
| [4] |
Liu J. Study on the cytoarchitecture of tectal SGC and distribution of some neuropeptides within the OT-Rt pathway in chick[D]. Baoding: Hebei Agricultural University, 2007. [刘佳.雏鸡中脑视顶盖SGC层细胞构筑及几种神经肽在OT-Rt通路的定位研究[D].保定: 河北农业大学, 2007.]
|
| [5] |
Yamanome T, Mizusawa K, Hasegawa E I, et al. Green light stimulates somatic growth in the barfin flounder Verasper moseri[J]. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 2009, 311. |
| [6] |
Boeuf G, Le Bail P Y. Does light have an influence on fish growth?[J]. Aquaculture, 1999, 177(1-4): 129-152. DOI:10.1016/S0044-8486(99)00074-5 |
| [7] |
Taylor J F, North B P, Porter M J R, et al. Photoperiod can be used to enhance growth and improve feeding efficiency in farmed rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 2006, 256(1-4): 216-234. DOI:10.1016/j.aquaculture.2006.02.027 |
| [8] |
Hallaråker H, Folkvord A, Stefansson S O. Growth of juvenile halibut (Hippoglossus hippoglossus) related to temperature, day length and feeding regime[J]. Netherlands Journal of Sea Research, 1995, 34(1-3): 139-147. DOI:10.1016/0077-7579(95)90022-5 |
| [9] |
Periago M J, Ayala M D, López-Albors O, et al. Muscle cellularity and flesh quality of wild and farmed sea bass, Dicentrarchus labrax L[J]. Aquaculture, 2005, 249(1-4): 175-188. DOI:10.1016/j.aquaculture.2005.02.047 |
| [10] |
Wang K, Cheng B J, Liu B, et al. Analysis on nutritive composition of muscle in wild and cultured Culter alburnus populations in Xingkai Lake at different ages[J]. Journal of Fishery Sciences of China, 2012, 19(5): 906-912. [王琨, 程宝晶, 刘斌, 等. 不同年龄野生和养殖兴凯湖翘嘴鲌肌肉营养成分分析[J]. 中国水产科学, 2012, 19(5): 906-912.] |
| [11] |
Ma A J, Liu X F, Zhai Y X, et al. Biochemical composition in muscle of wild and cultivated tongue sole (Cynoglossus semilaevis Günther)[J]. Marine Fisheries Research, 2006, 27(2): 49-54. [马爱军, 刘新富, 翟毓秀, 等. 野生及人工养殖半滑舌鳎肌肉营养成分分析研究[J]. 海洋水产研究, 2006, 27(2): 49-54.] |
| [12] |
Sun W T. Effects of Eucommia ulmoides active components on growth, flesh quality and collagen genes expression of grass carp (Ctenopharyngodon idella)[D]. Shanghai: Shanghai Ocean University, 2017. [孙文通.杜仲活性成分对草鱼生长、肌肉品质和胶原蛋白基因表达的影响[D].上海: 上海海洋大学, 2017.]
|
| [13] |
Li A J. Nutrition and Feed of Aquatic Animals[M]. Beijing: China Agriculture Press, 1996. [李爱杰. 水产动物营养与饲料学[M]. 北京: 中国农业出版社, 1996.]
|
| [14] |
Zeng B H, Liu H P, Wang J, et al. Effects of dietary protein levels on muscular amino acids and protein metabolism of Schizopygopsis younghusbandi younghusbandi Regan[J]. Journal of Fishery Sciences of China, 2019, 26(6): 1153-1163. [曾本和, 刘海平, 王建, 等. 饲料蛋白质水平对拉萨裸裂尻鱼幼鱼肌肉氨基酸及蛋白质代谢的影响[J]. 中国水产科学, 2019, 26(6): 1153-1163.] |
| [15] |
Dai M Y, Ren J L, Fei F, et al. Effects of LED light color on antioxidant capacity and digestibility of sea bass (Dicentrarchus labrax) juveniles[J]. Marine Sciences, 2019, 43(4): 16-21. [代明允, 任纪龙, 费凡, 等. LED光色对欧洲舌齿鲈幼鱼抗氧化能力和消化能力的影响[J]. 海洋科学, 2019, 43(4): 16-21.] |
| [16] |
Alasalvar C, Taylor K D A, Zubcov E, et al. Differentiation of cultured and wild sea bass (Dicentrarchus labrax): Total lipid content, fatty acid and trace mineral composition[J]. Food Chemistry, 2002, 79(2): 145-150. DOI:10.1016/S0308-8146(02)00122-X |
| [17] |
Carrillo M, Begtashi I, Rodríguez L, et al. Long photoperiod on sea cages delays timing of first spermiation and enhances growth in male European sea bass (Dicentrarchus labrax)[J]. Aquaculture, 2010, 299(1-4): 157-164. DOI:10.1016/j.aquaculture.2009.11.024 |
| [18] |
Villamizar N, Blanco-Vives B, Migaud H, et al. Effects of light during early larval development of some aquacultured teleosts: A review[J]. Aquaculture, 2011, 315(1-2): 86-94. DOI:10.1016/j.aquaculture.2010.10.036 |
| [19] |
Etherington D J, Sims T J. Detection and estimation of collagen[J]. Journal of the Science of Food and Agriculture, 1981, 32(6): 539-546. DOI:10.1002/jsfa.2740320603 |
| [20] |
Villamizar N, García-Alcazar A, Sánchez-Vázquez F J. Effect of light spectrum and photoperiod on the growth, development and survival of European sea bass (Dicentrarchus labrax) larvae[J]. Aquaculture, 2009, 292(1-2): 80-86. DOI:10.1016/j.aquaculture.2009.03.045 |
| [21] |
Barlow C G, Pearce M G, Rodgers L J, et al. Effects of photoperiod on growth, survival and feeding periodicity of larval and juvenile barramundi Lates calcarifer (Bloch)[J]. Aquaculture, 1995, 138(1-4): 159-168. DOI:10.1016/0044-8486(95)01073-4 |
| [22] |
Biswas A K, Seoka M, Takii K, et al. Stress response of red sea bream Pagrus major to acute handling and chronic photoperiod manipulation[J]. Aquaculture, 2006, 252(2-4): 566-572. DOI:10.1016/j.aquaculture.2005.06.043 |
| [23] |
Yuan Z Q, Tan Z L, Zeng J Y, et al. Feed efficiency and cellular energy metabolism[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(S1): 184-190. [袁章琴, 谭支良, 曾军英, 等. 饲料转换效率与细胞能量代谢[J]. 华北农学报, 2009, 24(S1): 184-190.] |
| [24] |
Keembiyehetty C N, Wilson R P. Effect of water temperature on growth and nutrient utilization of sunshine bass (Morone chrysops ♀× Morone saxatilis ♂) fed diets containing different energy/protein ratios[J]. Aquaculture, 1998, 166(1-2): 151-162. DOI:10.1016/S0044-8486(98)00277-4 |
| [25] |
Bing X W, Zhang X Z. Evaluation of nutritional components and nutritive quality of the muscle of Oxyeleotris marmoratus Bleeker[J]. Periodical of Ocean University of China, 2006, 36(1): 107-111. [邴旭文, 张宪中. 斑驳尖塘鳢肌肉营养成分与品质的评价[J]. 中国海洋大学学报(自然科学版), 2006, 36(1): 107-111.] |
| [26] |
Fei F, Ren J L, Dai M Y, et al. Effects of five kinds of light color environments on nutritional quality of Dicentrarchus labrax[J]. Chinese Journal of Animal Nutrition, 2019, 31(5): 2431-2441. [费凡, 任纪龙, 代明允, 等. 5种光色环境对欧洲舌齿鲈营养品质的影响[J]. 动物营养学报, 2019, 31(5): 2431-2441.] |
| [27] |
Wang H B, Liang Y P, Wang H Y, et al. Isolation and partial biological properties of scale collagens from grass carp (Ctenopharyngodon idellus)[J]. Journal of Fisheries of China, 2012, 36(4): 553-561. [汪海波, 梁艳萍, 汪海婴, 等. 草鱼鱼鳞胶原蛋白的提取及其部分生物学性能[J]. 水产学报, 2012, 36(4): 553-561.] |
| [28] |
Zhou L. The comparison study of meat quality parameter on differents domastic livestock and poultry breeds[D]. Urumqi: Xinjiang Agricultural University, 2007. [周磊.不同品种畜禽肉品质参数的比较研究[D].乌鲁木齐: 新疆农业大学, 2007.]
|
| [29] |
Ren Z L, Li A J. Influence of dietary composition on the collagen content, the myofibrillae and the water loss in muscle tissue of prawn[J]. Journal of Fishery Sciences of China, 1998, 5(2): 40-44. [任泽林, 李爱杰. 饲料组成对中国对虾肌肉组织中胶原蛋白、肌原纤维和失水率的影响[J]. 中国水产科学, 1998, 5(2): 40-44.] |
| [30] |
Liu B H. Cloning, mRNA expression analysis and regulation research in vivo of full length type I collagen cDNA from I grass carp (Ctenopharyngodon idellus)[D]. Shanghai: Shanghai Ocean University, 2011. [刘邦辉.草鱼I型胶原蛋白基因cDNA全序列的克隆、组织分布及在体调控研究[D].上海: 上海海洋大学, 2011.]
|
| [31] |
Saito M, Takenouchi Y, Kunisaki N, et al. Complete primary structure of rainbow trout type I collagen consisting of α1(I) α2(I) α3(I) heterotrimers[J]. European Journal of Biochemistry, 2001, 268(10): 2817-2827. DOI:10.1046/j.1432-1327.2001.02160.x |
| [32] |
Zhuang P, Song C, Zhang L Z, et al. Evaluation of nutritive quality and nutrient components in the muscle of Siganus oramin[J]. Journal of Fisheries of China, 2008, 32(1): 77-83. [庄平, 宋超, 章龙珍, 等. 黄斑篮子鱼肌肉营养成分与品质的评价[J]. 水产学报, 2008, 32(1): 77-83.] |
| [33] |
Xiong H S, Zhu L. Handbook of Food Additives[M]. Beijing: China Light Industry Press, 2012. [熊慧珊, 朱玲. 食品添加剂手册[M]. 北京: 中国轻工业出版社, 2012.]
|
| [34] |
Karakatsouli N, Papoutsoglou S E, Pizzonia G, et al. Effects of light spectrum on growth and physiological status of gilthead seabream Sparus aurata and rainbow trout Oncorhynchus mykiss reared under recirculating system conditions[J]. Aquacultural Engineering, 2007, 36(3): 302-309. DOI:10.1016/j.aquaeng.2007.01.005 |
| [35] |
Wang J Y, Zhu S G, Xu C F. Essential Biochemistry[M]. Beijing: Higher Education Press, 2008. [王镜岩, 朱圣庚, 徐长法. 生物化学教程[M]. 北京: 高等教育出版社, 2008.]
|
| [36] |
Zhang Y Z, Yang Y M, Wang L, et al. Comparative study of the muscle fatty acid composition of different families of half smooth tongue sole (Cynoglossus semilaevis)[J]. Journal of Fishery Sciences of China, 2016, 23(2): 417-424. [张永珍, 杨英明, 王磊, 等. 半滑舌鳎不同家系肌肉中脂肪酸含量的分析[J]. 中国水产科学, 2016, 23(2): 417-424.] |
| [37] |
Henderson R J, Sargent J R, Hopkins C C E. Changes in the content and fatty acid composition of lipid in an isolated population of the capelin Mallotus villosus during sexual maturation and spawning[J]. Marine Biology, 1984, 78(3): 255-263. DOI:10.1007/BF00393011 |
| [38] |
Bing X W. Comparative nutrition in muscles of Spinibarbus sinensis and S. hollandi[J]. Journal of Dalian Fisheries University, 2005, 20(3): 233-237. [邴旭文. 中华倒刺鲃和光倒刺鲃肌肉营养品质的比较[J]. 大连水产学院学报, 2005, 20(3): 233-237.] |
| [39] |
Shi X L, Xu Y J, Mou J T, et al. Analysis of amino acids fatty acids of Hippocampus kuda and Solenognathus hardwickii[J]. Chinese Journal of Marine Drugs, 2017, 36(2): 75-83. [史筱莉, 徐永健, 牟金婷, 等. 大海马和刁海龙氨基酸与脂肪酸的组成分析与评价[J]. 中国海洋药物, 2017, 36(2): 75-83.] |
| [40] |
Mourente G, Odriozola J M. Effect of broodstock diets on lipid classes and their fatty acid composition in eggs of gilthead sea bream (Sparus aurata L[J]. Fish Physiology and Biochemistry, 1990, 8(2): 93-101. DOI:10.1007/BF00004436 |
| [41] |
Sheng C, Qiu Z Y, Hong M L, et al. Effects of dietary lipid on fatty acid composition of different tissues in Chinese strip-necked turtle Mauremys sinensis[J]. Fisheries Science, 2017, 36(3): 341-346. [盛成, 裘正元, 洪美玲, 等. 脂质对中华花龟不同组织脂肪酸组成的影响[J]. 水产科学, 2017, 36(3): 341-346.] |
 2020, Vol. 27
2020, Vol. 27

