2. 上海海洋大学, 水产科学国家级实验教学示范中心, 上海 201306
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
近年来, 中国虾类养殖业迅猛发展, 冰鲜杂鱼、麻虾等冰鲜饲料因其适口性与可得性较好, 被广泛应用到养殖生产中。然而冰鲜饲料稳定性差, 在进入水体后, 很大一部分会直接散失到水体中, 导致水体富营养化、滋生病菌、危害环境, 由此引发的问题困扰着对虾养殖业的可持续发展[1-2]。而人工配合饲料可根据不同养殖对象合理搭配各种营养成分, 提高蛋白的利用效率, 减少水体氮磷的排放量。因此, 用人工配合饲料代替冰鲜饲料已经成为一种趋势[3]。目前对人工配合饲料的开发已涉及南美白对虾(Litopenaeus vanna¬mei)[4-5]、斑节对虾(Penaeus monodon)[6-7]及红螯螯虾(Cherax quadricarinatus)[8]等诸多种类, 然而受困于目前饲料加工条件, 人工配合饲料在营养和工艺层面难以全程满足对虾养殖需求[9], 这就导致在实际养殖过程中, 冰鲜杂鱼、麻虾等冰鲜饲料投喂量仍占据较高比例。因此, 研究冰鲜饲料与人工配合饲搭配策略, 对进一步认识当前生产中仍在广泛运用的混合投喂模式的利与弊, 具有重要的现实意义。
脊尾白虾俗称小白虾, 是中国大陆特有的经济虾类之一。由于具有生长快、繁殖性能好、抗病能力强等诸多优点, 脊尾白虾养殖面积不断扩大, 其养殖面积可占多元养殖池塘总养殖面积的三分之一[10]。目前, 脊尾白虾养殖幼苗阶段采用人工配合饲料投喂, 养殖阶段仍以“冰鲜饲料+人工配合饲料”混合投喂为主, 迄今为止, 尚未见全程投喂人工配合饲料的脊尾白虾的养殖报道。有关脊尾白虾的研究也局限在基因与环境互作作用[11-12]、功能基因的挖掘[13-14]、营养成分分析[15-16]及基因组学测序[17-20]等方面, 对脊尾白虾的饲料投喂模式还未见报道。池塘多元养殖(pond poly¬cul¬ture)俗称混养, 它能充分利用池塘空间, 提升经济效益。目前与脊尾白虾混养的种类主要有梭子蟹(Portunus trituberculatus)和拟穴青蟹(Scylla paramamosain)等, 还未见与文蛤(Meretrix meretrix)混养的报道。本研究通过研究不同饲料投喂模式对与文蛤混养的脊尾白虾生长、消化酶、体成分及养殖水环境的影响, 旨在为脊尾白虾的人工配合饲料开发及生态健康养殖提供科学参考与理论基础。
1 材料与方法 1.1 实验材料实验所用脊尾白虾均取自江苏省文蛤良种场吕四基地, 挑选健康活跃、大小基本一致的脊尾白虾[初始体重为(0.23±0.03) g], 随机分配到室内水泥池中暂养7 d。实验所用冰鲜饲料购自江苏启东金龙水产经营部, 实验前融化后取肉糜使用(Diet1);所用配合饲料由启东施卫萍家庭农场配制(Diet3);混合饲料为肉糜与配合饲料按1:1的比例混合加水搅拌捻成饼状(Diet2) (表 1)。
|
|
表 1 饲料原料及营养成分分析 Tab.1 Formulation and nutrient level of the diets |
实验在江苏文蛤良种场吕四基地大棚内9个虾贝多元养殖池中进行, 多元生态养殖池边设有平台用于文蛤养殖, 深水区用于脊尾白虾养殖(图 1, 图 2)。文蛤放养密度为225粒/m3, 脊尾白虾放养密度为150尾/m3。实验设置3个实验组, 即投喂冰鲜饲料组(Diet1组), 混合实验组(Diet2组)和投喂人工配合饲料组(Diet3组)。实验所用水为经过沙滤和黑暗沉淀的吕四近海水, 实验期间采用小型气泵连续曝气, 溶氧DO>6.5 mg/L, 水温20~28 ℃, 水质初始指标为:化学需氧量(COD) 2.987 mg/L, 氨氮0.015 mg/L, 亚硝酸盐0.022 mg/L, 硝酸盐未检出, 无机氮0.037 mg/L, 无机磷0.0021 mg/L, pH 7.5~8.5, 实验期间每天7:00和17:00各投喂1次, 投喂量为虾总体重的5%, 养殖实验共持续45 d。
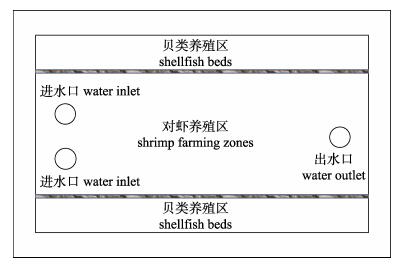
|
图 1 虾贝多元养殖池示意图 Fig.1 Diagram of the polyculture pond |

|
图 2 虾贝多元养殖池剖面图 Fig.2 Profile diagram of the polyculture pond |
分别于养殖实验的第5天、10天、15天、20天、25天、30天、35天、40天和45天随机取15尾脊尾白虾, 测量其体重, 测量后迅速放回池中。同时在各时间点各取500 mL水样4%甲醛溶液固定运回实验室, 4 ℃冰箱保存, 并用于水质指标测定。实验结束后, 收集每个池中脊尾白虾, 记录存活数并进行称重。然后随机取5尾脊尾白虾置于冰面解剖, 取其肝胰腺, 于–80 ℃冰鲜保存, 用于消化酶的测定。另取10尾虾–20 ℃保存, 用于体成分分析。
1.4 指标测定 1.4.1 生长性能分析实验虾的存活率、增重率和特定生长率的计算公式如下:
存活率(survival rate, SR)=nt/n0×100%;
增重率(weight gain rate, WGR)= (Wt2–Wt1)/Wt1×100%;
特定增长率(specific growth rate, SGR)= (lnWt2–lnWt1)×100%/t
式中, nt为实验结束时脊尾白虾的数量, n0为实验开始时脊尾白虾的数量, Wt2为每次采样时测定的虾的质量(g), Wt1为上次采样时测定的虾的质量(g), t为两次采样间隔时间(d)。
1.4.2 消化酶活性的测定实验所取脊尾白虾肝胰腺中蛋白酶、脂肪酶、淀粉酶活性及总蛋白含量均采用南京建成生物工程研究所研制的试剂盒测定。
1.4.3 体成分的测定将整虾样品放入烘箱中, 烘干至恒重, 根据烘干前后质量的变化算出水分的含量。采用马弗炉550 ℃灼烧法(GB/T 5009.4- 1985)测定灰分含量; 索氏抽提法(GB/T 5009.6- 1985, 上海力辰邦西仪器科技有限公司, SZF- 06B脂肪测定仪)测定粗脂肪含量; 凯氏定氮法(GB/T 5009.5-1985, 上海力辰邦西仪器科技有限公司, HR-500全自动定氮仪)测定粗蛋白含量。
1.4.4 水质指标测定实验测定的水质指标主要包括水体中的COD、氨氮(NH4+-N)、亚硝酸盐(NO2–-N)、硝酸盐(NO3–-N)、无机氮(IN)、无机磷(IP); 其中COD含量通过碱性高锰酸钾法测定; 氨氮含量通过次溴酸盐氧化法测定; 亚硝酸盐含量通过磺胺–盐酸萘乙二胺法测定; 硝酸盐含量采用锌镉还原法测定; 无机磷含量通过钼蓝分光光度法测定; 无机氮含量计算公式如下:
| $ {C_{{\rm{IN}}}} = {C_1} + {C_2} + {C_3} $ |
式中, CIN为水体无机氮含量(mg/L), C1、C2及C3分别为水体氨氮、亚硝酸盐及硝酸盐含量(mg/L)。
1.5 数据处理采用SPSS19.0软件对实验数据进行单因素方差分析(one-way ANOVA)及LSD法多重比较, 采用OriginPro 2016绘制柱状图。实验数据均用平均值±标准差(x±SD)表示。
2 结果与分析 2.1 不同饲料投喂模式对脊尾白虾生长性能的影响实验结束时, 各实验组脊尾白虾的存活率均高于90%, 各实验组间死亡率没有显著差异(P>0.05)。投喂不同饵料对脊尾白虾生长性能的影响如图 3所示。统计分析结果表明, 在第30天之前, 3个实验组脊尾白虾体重差异不显著(P>0.05);在第30天后, Diet2组脊尾白虾的体重显著高于Diet1组和Diet3组(P < 0.05), 而Diet1组与Diet3组之间差异不显著(P>0.05)。增重率和特定生长率随着实验的进行呈下降趋势, 其中在35 d之前, Diet2组脊尾白虾的增重率和特定生长率显著高于Diet1组和Diet3组(P < 0.05), 40 d之后, 各实验组增重率和特定生长率之间差异不显著(P < 0.05)。
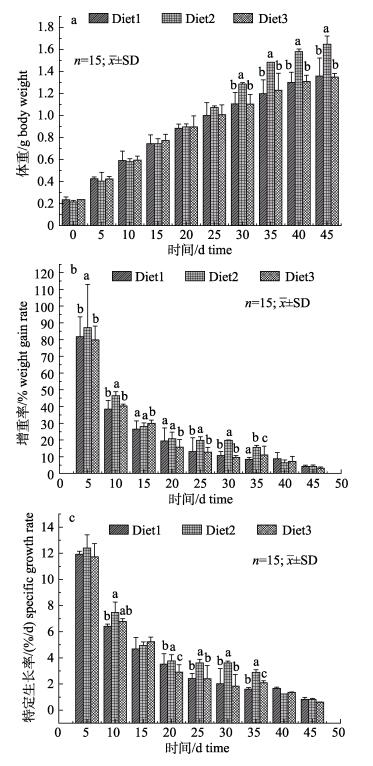
|
图 3 不同饲料投喂模式对脊尾白虾生长性能的影响 Diet1:冰鲜饲料组; Diet2:混合投喂组; Diet3:人工配合饲料组.柱状图上方不同的小写字母表示同一时间不同实验组之间差异显著(P < 0.05). Fig.3 Effects of different feeding modes on growth performance of Exopalaemon carinicauda Diet1: chilled feed group; Diet2: chilled feed+artificial diet group; Diet3: artificial diet group. Different letters indicate significant differences between different groups at the same time (P < 0.05). |
由图 4所示, 不同饲料投喂模式对脊尾白虾消化酶有一定影响。蛋白酶活性Diet1组最高[(2.79±0.35) U/mg (prot)], Diet2组次之[(2.40±0.47) U/mg (prot)], Diet3组最低[(1.74±0.36) U/mg (prot)]。Diet1组蛋白酶活性显著高于Diet3组(P < 0.05)。Diet1组、Diet2组和Diet3组脂肪酶活性分别是[(1.33±0.18)U/mg(prot)]、[(1.25± 0.11) U/mg(prot)]、[1.12±0.18 U/mg(prot)], 3个实验组脂肪酶活性无显著差异(P>0.05)。淀粉酶活力Diet3组最高[(34.49±1.19) U/mg(prot)], Diet2组次之[(32.53± 1.33)U/mg(prot)], Diet1组最低[(28.51±2.10) U/mg(prot)]。Diet2组淀粉酶活性显著高于Diet1组(P < 0.05), 与Diet3组无显著差异(P>0.05)。
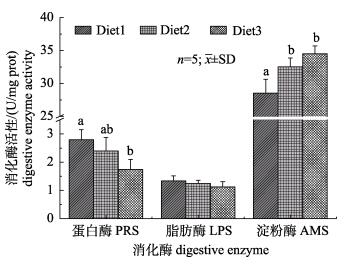
|
图 4 不同饲料投喂模式对脊尾白虾消化酶活性的影响 Diet1:冰鲜饲料组; Diet2:混合投喂组; Diet3:人工配合饲料组.柱状图上方不同的小写字母表示同一种酶不同实验组之间差异显著(P < 0.05). Fig.4 Effects of different feeding modes on digestive enzyme activity of Exopalaemon carinicauda Diet1: chilled feed group; Diet2: chilled feed+artificial diet group; Diet3: artificial diet group. Different letters indicate significant differences between different groups for the same enzyme (P < 0.05). |
由表 2可知, 不同饲料投喂模式对脊尾白虾体成分有一定影响。其中Diet2组脊尾白虾粗蛋白含量最高, Diet1组次之, Diet3组最低, Diet2组脊尾白虾粗蛋白含量显著高于Diet3组(P < 0.05), 与Diet1组差异不显著(P>0.05)。Diet2组脊尾白虾水分含量显著低于Diet1组和Diet3组(P < 0.05)。各实验组之间脊尾白虾粗脂肪含量与灰分含量差异不显著(P>0.05)。
|
|
表 2 不同饲料投喂模式对脊尾白虾体成分的影响 Tab.2 Effects of different feeding modes on whole body composition of Exopalaemon carinicauda |
由图 5a所示, 随着实验的进行, 各实验组脊尾白虾养殖水体COD含量均呈上升趋势。在实验进行30 d时, Diet1组和Diet2组水体COD含量均超过10 mg/L; 在实验进行40 d后, 各实验组COD含量均超过10 mg/L (SC/T 9103-2017水产行业一级排放标准)。实验进行20 d后, Diet1组和Diet2组水体COD含量显著高于Diet3组(P < 0.05);在20~40 d时, Diet1组和Diet2组差异不显著(P>0.05);第45天时, Diet1组水体COD含量显著高于Diet2和Diet3组, 且Diet2组COD含量也显著高于Diet3组(P < 0.05)。
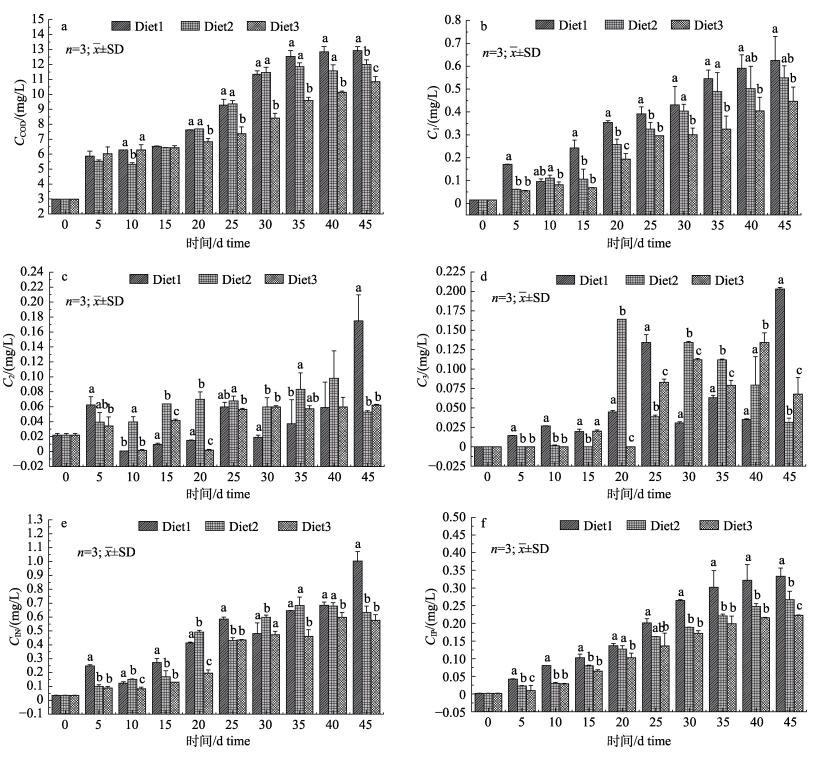
|
图 5 不同饲料投喂模式对脊尾白虾养殖水质的影响 Diet1:冰鲜饲料组; Diet2:混合投喂组; Diet3:人工配合饲料组; CCOD: COD含量; C1, C2, C3分别指氨氮、亚硝酸盐和硝酸盐含量; CIN:无机氮含量; CIP无机磷含量.柱状图上方不同的小写字母表示同一时间不同实验组之间差异显著(P < 0.05). Fig.5 Effects of different feeding modes on aquaculture water quality of Exopalaemon carinicauda Diet1: chilled feed group; Diet2: chilled feed+artificial diet group; Diet3: artificial diet group. CCOD: concentration of COD; C1, C2, C3 refer to concentration of ammonia nitrogen, nitrite and nitrate, respectively; CIN: concentration of inorganic nitrogen; CIP: concentration of inorganic phosphorus. Different letters indicate significant differences between different groups at the same time (P < 0.05). |
由图 5e所示, 随着实验的进行, 各实验组水体无机氮含量均呈上升趋势, 实验在第45天时, 仅有Diet1组水体无机氮含量超过1 mg/L (SC/T9103-2017水产行业一级排放标准), Diet2组和Diet3组水体无机氮含量均介于0.1~1 mg/L之间, 符合二级排放标准。在实验第5~45天时, Diet1组水体无机氮含量显著高于Diet3组(P < 0.05)。由图 5b所示, 随着实验的进行, 各实验组水体氨氮含量均呈上升趋势。水体氨氮含量由高到低依次为Diet1组、Diet2组、Diet3组, 其中Diet1组水体氨氮含量显著高于Diet3组(P < 0.05)。由图 5c和图 5d所示, 各实验组水体亚硝酸盐和硝酸盐含量总体呈上升趋势, 在实验结束时, Diet1组水体亚硝酸盐和硝酸盐含量显著高于Diet2组或Diet3组(P < 0.05)。
2.4.3 不同饲料投喂模式对脊尾白虾养殖水体无机磷(IP)含量的影响由图 5f所示, 随着实验的进行, 各实验组水体无机磷含量均呈上升趋势, 在第20天时, 各实验组水体无机磷含量均超过0.1 mg/L (SC/T9103-2017水产行业二级排放标准)。水体无机磷含量由高到低依次为Diet1组、Diet2组、Diet3组, 其中Diet1组水体无机磷含量显著高于Diet3组(P < 0.05)。
3 讨论 3.1 不同饲料投喂模式对脊尾白虾生长性能的影响在生产养殖过程中, 饲料被认为是决定水产动物生长和盈利的重要因素之一。不同饲料因其可得性、适口性、诱食效果及糖类、蛋白、脂肪等营养成分差异, 对养殖对象生长性能有不同的影响[21]。许多研究发现“鲜活饵料+人工配合饲料”混合投喂模式有利于长薄鳅(Leptobotia elongata)[21]、南美白对虾[22]和中华绒螯蟹(Eriocheir sinensis)[23]等的生长。本研究发现, 不同饲料投喂30 d后, Diet2组脊尾白虾的体重显著高于Diet1组和Diet3组(P < 0.05), 而Diet1组与Diet3组之间差异不显著(P>0.05), 在实验第35天之前, Diet2组增重率和特定生长率也显著高于Diet1组和Diet3组(P < 0.05)。一方面可能是因为投喂单一种类饲料, 造成脊尾白虾营养不均衡; 另一方面可能因为单一冰鲜饲料或人工配合饲料其所含蛋白或糖类水平不在脊尾白虾最佳利用范围。董兰芳等[24-25]研究发现, 拟穴青蟹(Scylla paramamosain)幼蟹饲料蛋白质适宜水平为49.03%, 糖类最适添加水平为29.93%。达到此水平时, 拟穴青蟹幼蟹生长显著高于其余添加量(P < 0.05), 姜松等[26]研究发现饲料蛋白水平达到38%时, 斑节对虾(Penaeus monodon)可获得较快的生长。本研究推测脊尾白虾饲料蛋白质适宜水平应与Diet2组接近, 数值在29.02%左右。因此, 脊尾白虾饲料蛋白质添加水平还需进行定量化研究。另外, 曹梅等[27]研究发现粗脂肪含量达8.67%时, 能显著促进脊尾白虾生长, 而本研究中各组饲料中脂肪均远小于此值(最高水平为4.23%), 难以满足脊尾白虾生长需要, 也是限制脊尾白虾生长的原因之一。
3.2 不同饲料投喂模式对脊尾白虾消化酶活性的影响饲料组成是影响甲壳动物消化酶活性的重要因素[28]。甲壳动物在摄食不同组成的饲料后消化酶分泌量会出现差异, 以便更好地消化、吸收和利用饲料中的营养物质[29]。本研究结果显示, 各实验组淀粉酶活性显著大于蛋白酶和脂肪酶活性(P < 0.05)。其可能原因是, 各实验组饲料组成成分中淀粉或糖类水平都比较高。从Diet1组至Diet3组, 饲料中蛋白水平逐渐降低, 而脊尾白虾蛋白酶活性逐渐降低, 淀粉酶活性逐渐提高。蛋白酶和淀粉酶活性的变化正是脊尾白虾对饲料蛋白质和糖含量变化的适应, 与拟穴青蟹[25]、克氏原螯虾(Procambarus clarkii)[30]等消化酶活性变化规律一致。另外, 由于饲料中脂肪均处于较低水平, 且无显著差异(P>0.05), 故脊尾白虾脂肪酶活性很低, 且无显著差异(P>0.05)。而潘鲁青等[29]认为甲壳动物的脂肪酶活性测不出或者活性很低, 是目前脂肪酶检测方法存在问题, 董兰芳等[25]在研究不同蛋白质水平对拟穴青蟹幼蟹的脂肪酶的影响时, 也得出相似结论。
3.3 不同饲料投喂模式对脊尾白虾体成分的影响不同饲料因其组成成分的差异, 对养殖对象的体成分有不同程度的影响。一般来说, 随着饲料蛋白质水平的提高, 动物体内蛋白质含量会有所升高, 达到一定程度后趋于稳定[31]。陈曦飞等[32]和宋青青等[33]认为, 动物机体合成组织蛋白的能力有一定上限, 吸收到体内的氨基酸首先被用于机体组织蛋白的更新与修复, 若有剩余则合成蛋白用于生长, 若仍有剩余, 这部分氨基酸将作为能源被消耗[25, 34]。本研究结果显示, 从Diet1组至Diet3组饲料中蛋白水平逐渐降低, 而Diet2组脊尾白虾粗蛋白含量最高, Diet1组次之, Diet3组最低, 其中Diet2组粗蛋白含量显著高于Diet3组(P < 0.05), 与Diet1组差异不显著(P>0.05)。可能是由于脊尾白虾机体合成蛋白的能力在摄入饲料蛋白量29.02% (Diet2组)时, 达到了上限。该结果与拟穴青蟹[25]、斑节对虾[27]及日本沼虾(Macrobrachium nipponense)[35]等研究结果相似。此外, Diet2组脊尾白虾水分含量显著低于Diet1组和Diet3组(P < 0.05), 可能是由于脊尾白虾体内蛋白积累所致, 姜松等[27]及张凌燕等[36]均得出相似结论。灰分主要是由甲壳质及钙质形成[29], 本研究中各实验组之间灰分含量差异不显著(P>0.05), 说明投喂上述3种不同饲料对脊尾白虾壳质形成影响不显著。甲壳动物体脂主要是靠摄入高糖类的饲料维持[27]。本研究中各实验组之间脊尾白虾粗脂肪含量差异不显著(P>0.05), 其原因可能是不同饲料中糖类含量虽有差异, 但不足以在脊尾白虾体内形成过多脂肪。
3.4 不同饲料投喂模式对脊尾白虾养殖水体水质的影响饲料作为外来营养源, 在被养殖对象摄食后, 经过微生物作用主要以无机氮和无机磷形式进入水体, 进而提高水体的氮磷含量[37]。随着养殖时间的延长, 水体无机氮和无机磷含量逐渐积累。本实验结果显示, Diet1组水体无机氮和无机磷含量显著高于Diet3组(P < 0.05)。其原因可能是冰鲜饲料中氮磷含量高于人工配合饲料。氨氮、亚硝酸盐和硝酸盐会影响养殖对象的生长发育。有研究表明氨氮和亚硝酸盐含量的升高会降低水产动物的免疫能力, 损伤机体组织器官, 导致其生长速度减缓, 氨氮含量过高甚至会导致水生动物发生死亡[38-39]。而本研究中脊尾白虾增重率与特定生长率逐渐降低, 推测氨氮和亚硝酸盐对脊尾白虾的生长具有抑制作用, 李志辉等[40]在研究不同养殖密度对脊尾白虾生长和水体氨氮含量的影响时, 也得出相似结论。因此在实际养殖过程中, 可适当减少冰鲜饲料的投喂, 以减缓水体氨氮和亚硝酸盐含量的积累。另外, 本养殖实验过程中, 养殖水体COD含量及无机氮含量均符合SC/T 9103- 2017水产行业二级排放标准(0.1 mg/L), 而养殖20 d后, 养殖水体各实验组无机磷含量均超过SC/T 9103-2017水产行业二级排放标准, 造成水体富营养化现象, 建议在实际养殖过程中要清除水体中残饵和粪便, 并通过栽培水生植物或藻类对水体无机磷进行有效控制。
4 结论鉴于冰鲜饲料对水体高污染的现状, 环保部门已逐渐限制甚至禁用投喂冰鲜饲料, 研制环保型人工配合饲料仍是大势所趋。然而受限于目前饲料加工条件与营养添加水平, 全程使用人工配合饲料还不能满足生产需要, “冰鲜饲料+人工配合饲料”混合投喂模式仍将继续存在。通过本研究发现, 采取“冰鲜饲料+人工配合饲料”混合投喂模式, 有利于脊尾白虾的生长、消化及蛋白积累, 因此在目前实际养殖过程中仍广泛使用。然而这种投喂方式对养殖水质仍存在一定的污染, 因此, 要加快研制满足脊尾白虾生长的环保型人工配合饲料, 以满足脊尾白虾可持续生产的需要。
| [1] |
Wang Y Z, Xu X J, Yan Q P, et al. Bacterial composition in feed mash of fresh frozen trash fish for large yellow croaker (Larimichthys crocea)[J]. South China Fisheries Science, 2014, 10(3): 53-57. [王勇忠, 徐晓津, 鄢庆枇, 等. 大黄鱼冰鲜杂鱼饲料中细菌多样性研究[J]. 南方水产科学, 2014, 10(3): 53-57.] |
| [2] |
Mou M M, Jiang Y, Luo Q, et al. Effects of formulated diet and fresh frozen Hypophthalmichthys molitrix on growth, plasma biochemical index and antioxidant ability and histology of Micropterus salmoides[J]. Journal of Fisheries of China, 2018, 42(9): 1408-1416. [牟明明, 蒋余, 罗强, 等. 配合饲料和冰鲜鲢对大口黑鲈生长、血浆生化指标、抗氧化能力和组织学的影响[J]. 水产学报, 2018, 42(9): 1408-1416.] |
| [3] |
Liu Z F, Gao X Q, Yu J X, et al. Effects of different diets on growth performance, enzyme activity, and body fatty acid composition in larval American shad (Alosa sapidissima)[J]. Journal of Fishery Sciences of China, 2018, 25(1): 97-107. [刘志峰, 高小强, 于久翔, 等. 不同饵料对美洲西鲱仔鱼生长、相关酶活力及体脂肪酸的影响[J]. 中国水产科学, 2018, 25(1): 97-107.] |
| [4] |
Yang Q H, Tan B P, Dong X H, et al. Replacement of fish meal with peanut meal in diets for white shrimp (Litopenaeus vannamei Boone)[J]. Chinese Journal of Animal Nutrition, 2011, 23(10): 1733-1744. [杨奇慧, 谭北平, 董晓慧, 等. 凡纳滨对虾饲料中用花生粕替代鱼粉的研究[J]. 动物营养学报, 2011, 23(10): 1733-1744.] |
| [5] |
Gou N N, Zhang J L. The comparison study on feed protein demand of Litopenaeus vannamei cultured in seawater and desalinated water[J]. Genomics and Applied Biology, 2019, 38(3): 1039-1047. [苟妮娜, 张建禄. 海水和淡化水养殖凡纳滨对虾饲料蛋白需求量的比较研究[J]. 基因组学与应用生物学, 2019, 38(3): 1039-1047.] |
| [6] |
Lu X, Niu J, Lin H Z, et al. Optimal supplemental level of dietary wakame for juvenile Penaeus monodon[J]. Chinese Journal of Animal Nutrition, 2014, 26(6): 1496-1502. [芦雪, 牛津, 林黑着, 等. 裙带菜在斑节对虾幼虾饲料中的适宜添加量[J]. 动物营养学报, 2014, 26(6): 1496-1502.] |
| [7] |
Zhang J R, Jiang S G, Lin H Z, et al. Effects of different brands of feeds on growth of black tiger shrimp (Penaeus monodon) and water quality[J]. South China Fisheries Science, 2013, 9(6): 20-26. [张加润, 江世贵, 林黑着, 等. 不同品牌饲料对斑节对虾生长及水质影响的研究[J]. 南方水产科学, 2013, 9(6): 20-26.] |
| [8] |
Wang D D. Effects of dietary phosphorus and calcium to phosphorus ratio on growth, activity of tissue protease and alkaline phosphatase of juvenile red claw crayfish (Cherax quadricarinatus)[D]. Ningbo: Ningbo University, 2008. [王冬冬.饲料磷及钙磷比对红螯螯虾幼虾生长和组织蛋白酶、碱性磷酸酶活性的影响[D].宁波: 宁波大学, 2008.]
|
| [9] |
Yang Z G, Chen N S, Zheng J W. Research progress of environmental protection aquatic feed[J]. Fisheries Science & Technology Information, 2009, 36(3): 140-142. [杨志刚, 陈乃松, 郑剑伟. 环保型水产饲料的研究进展[J]. 水产科技情报, 2009, 36(3): 140-142.] |
| [10] |
Xu W J, Xie J J, Shi H, et al. Hematodinium infections in cultured ridgetail white prawns, Exopalaemon carinicauda, in Eastern China[J]. Aquaculture, 2010, 300(1-4): 25-31. DOI:10.1016/j.aquaculture.2009.12.024 |
| [11] |
Zhang C S, Yu K J, Li F H, et al. Acute toxic effects of zinc and mercury on survival, standard metabolism, and metal accumulation in juvenile ridgetail white prawn, Exopalaemon carinicauda[J]. Ecotoxicology and Environmental Safety, 2017, 145: 549-556. DOI:10.1016/j.ecoenv.2017.07.075 |
| [12] |
Chen X, Qiu L, Wang H L, et al. Susceptibility of Exopalaemon carinicauda to the infection with shrimp hemocyte iridescent virus (SHIV 20141215), a strain of decapod iridescent virus 1 (DIV1)[J]. Viruses, 2019, 11(4): 387. DOI:10.3390/v11040387 |
| [13] |
Zhang J Q, Liu Y J, Zhou Y Z, et al. Cloning of a trehalose-6-phosphate synthase gene from Exopalaemon carinicauda and its expression response to bacteria challenge[J]. Fish & Shellfish Immunology, 2019, 93: 387-394. |
| [14] |
Zhang J Q, Song F G, Sun Y Y, et al. CRISPR/Cas9-mediated deletion of EcMIH shortens metamorphosis time from mysis larva to postlarva of Exopalaemon carinicauda[J]. Fish & Shellfish Immunology, 2018, 77: 244-251. |
| [15] |
Zhang C S, Li S H, Yu Y, et al. Comparative study on nutrient composition and quality evaluation in a new variety and wild-typed ridgetail white prawn (Exopalaemon carinicauda)[J]. Aquaculture Research, 2019, 50(11): 3223-3230. DOI:10.1111/are.14277 |
| [16] |
Shi W J, Jiang G, Shen H, et al. Analysis on meat nutritive composition of ridgetail white prawn "kesuhong No[J]. The Food Industry, 2019, 40(7): 304-308. [史文军, 蒋葛, 沈辉, 等. 脊尾白虾"科苏红1号"肌肉营养成分分析[J]. 食品工业, 2019, 40(7): 304-308.] |
| [17] |
Li J T, Li J, Chen P, et al. Transcriptome analysis of eyestalk and hemocytes in the ridgetail white prawn Exopalaemon carinicauda: Assembly, annotation and marker discovery[J]. Molecular Biology Reports, 2015, 42(1): 135-147. DOI:10.1007/s11033-014-3749-6 |
| [18] |
Shen X, Sun M A, Wu Z G, et al. The complete mitochondrial genome of the ridgetail white prawn Exopalaemon carinicauda Holthuis, 1950 (Crustacean: Decapoda: Palaemonidae) revealed a novel rearrangement of tRNA genes[J]. Gene, 2009, 437(1-2): 1-8. DOI:10.1016/j.gene.2009.02.014 |
| [19] |
Yuan J B, Gao Y, Zhang X J, et al. Genome sequences of marine shrimp Exopalaemon carinicauda Holthuis provide insights into genome size evolution of Caridea[J]. Marine Drugs, 2017, 15(7): 213. DOI:10.3390/md15070213 |
| [20] |
Zhang Q, Zhang C S, Yu Y, et al. Characteristic analysis of simple sequence repeats in the ridgetail white prawn Exopalaemon carinicauda genome and its application in parentage assignment[J]. Journal of the World Aquaculture Society, 2019, 51(3). DOI:10.1111/jwas.12650 |
| [21] |
Zhang J M. Effect of different diets on growth performance of elongate loach Leptobotia elongata[J]. Fisheries Science, 2019, 38(2): 207-212. [张建明. 投喂不同饵料对长薄鳅生长的影响[J]. 水产科学, 2019, 38(2): 207-212.] |
| [22] |
Zhao Y C, Qin H, Li Y Q, et al. Effects of stocking density and food types on growth and agonistic behavior in Pacific white leg shrimp Litopenaeus vannamei[J]. Chinese Journal of Fisheries, 2016, 29(3): 44-48. [赵玉超, 秦浩, 李玉全, 等. 密度和饲料种类对凡纳滨对虾Litopenaeus vannamei争胜行为和生长的影响[J]. 水产学杂志, 2016, 29(3): 44-48.] |
| [23] |
Ge Y C, Jiang X D, Zhang J B, et al. Effects of formulated feed and fresh frozen trash fish on gonadal development and approximate composition of Chinese mitten handed crab Eriocheir sinensis in a pond culture[J]. Fisheries Science, 2017, 36(5): 551-556. [葛永春, 姜晓东, 张金彪, 等. 3种投喂模式对中华绒螯蟹性腺发育和生化组成的影响[J]. 水产科学, 2017, 36(5): 551-556.] |
| [24] |
Dong L F, Tong T, Zhang Q, et al. Effect of dietary protein level on growth performance, body composition, and digestive enzyme activities in green mud crab (Scylla paramamosain) juveniles[J]. Journal of Fishery Sciences of China, 2017, 24(3): 524-532. [董兰芳, 童潼, 张琴, 等. 饲料蛋白质水平对拟穴青蟹幼蟹生长性能、体成分和消化酶活性的影响[J]. 中国水产科学, 2017, 24(3): 524-532.] |
| [25] |
Dong L F, Tong T, Zhang Q, et al. Effects of dietary carbohydrate level on growth performance, body composition and digestive enzyme activities of juvenile crab, Scylla paramamosain[J]. Acta Hydrobiologica Sinica, 2019, 43(2): 252-258. [董兰芳, 童潼, 张琴, 等. 饲料碳水化合物水平对拟穴青蟹稚蟹生长、体成分和消化酶活性的影响[J]. 水生生物学报, 2019, 43(2): 252-258.] |
| [26] |
Jiang S, Yang Q B, Huang J H, et al. Effects of dietary protein levels on growth, blood biochemical parameters and body composition of Penaeus monodon[J]. Marine Fisheries, 2014, 36(1): 44-50. [姜松, 杨其彬, 黄建华, 等. 饲料蛋白水平对斑节对虾生长、血液生化指标及体成分的影响[J]. 海洋渔业, 2014, 36(1): 44-50.] |
| [27] |
Cao M, Wang X Q, Yan B L, et al. Study on the requirements of protein and lipid for Exopalaemon carinicauda[J]. Journal of Huaihai Institute of Technology (Natural Science Edition), 2009, 18(1): 87-89. [曹梅, 王兴强, 阎斌伦, 等. 脊尾白虾对蛋白质和脂肪需求量研究[J]. 淮海工学院学报(自然科学版), 2009, 18(1): 87-89.] |
| [28] |
Wang J Y, Yang Z G, Wei B H, et al. Effects of different lipid sources on growth, digestive enzyme activity, and fatty acid composition in juvenile Chinese mitten crab, Eriocheir sinensis[J]. Journal of Fishery Sciences of China, 2017, 24(6): 1213-1222. [王健懿, 杨志刚, 魏帮鸿, 等. 不同脂肪源饲料对中华绒螯蟹幼蟹生长、消化酶活力和脂肪酸组成的影响[J]. 中国水产科学, 2017, 24(6): 1213-1222.] |
| [29] |
Pan L Q, Liu H Y, Xiao G Q. A review on digestive enzyme of crustacean larvae[J]. Journal of Fishery Sciences of China, 2006, 13(3): 492-501. [潘鲁青, 刘泓宇, 肖国强. 甲壳动物幼体消化酶研究进展[J]. 中国水产科学, 2006, 13(3): 492-501.] |
| [30] |
Deng H F. Effects of different light and diet on growth, non-specific immune enzymes and body composition of the crayfish, Procambarus clarkii[D]. Jingzhou: Yangtze University, 2018. [邓慧芳.不同光照和饲料对克氏原螯虾生长、非特异性免疫酶及体成分的影响[D].荆州: 长江大学, 2018.]
|
| [31] |
Deng J M, Mai K S, Ai Q H, et al. Protein turnover of fish: A review[J]. Journal of Fishery Sciences of China, 2007, 14(1): 165-172. [邓君明, 麦康森, 艾庆辉, 等. 鱼类蛋白质周转代谢的研究进展[J]. 中国水产科学, 2007, 14(1): 165-172.] |
| [32] |
Chen X F, Xu J, Ai C X. Protein requirement and feed assessment of Litopenaeus vannamei[C]//Low Carbon Crustacean Farming and Its Health and Safety: Proceedings on the Seventh Symposium of World's Chinese Scientists on Culture of Shrimp and Crab. Xiamen: Xiamen University Press, 2011: 246-255. [陈曦飞, 许洁, 艾春香.凡纳滨对虾的蛋白质营养需求研究及其配合饲料质量评价[C]//甲壳动物低碳养殖与健康安全: 第七届世界华人虾蟹类养殖研讨会论文集.厦门: 厦门大学出版社, 2011: 246-255.]
|
| [33] |
Song Q Q, Qi Z L. Aquatic Animal Nutrition and Feed Science[M]. Beijing: China Agricultural University Press, 2011: 27. [宋青青, 齐遵利. 水产动物营养与配合饲料学[M]. 北京: 中国农业大学出版社, 2011: 27.]
|
| [34] |
NRC (National Research Council). Nutrient Requirements of Fishes[M]. Washington D C: National Academy Press, 1993: 5.
|
| [35] |
Xie G S, Cai Y X, Xu W N, et al. Effects of dietary protein levels on growth, digestive enzyme activities and immune enzyme activities of Macrobrachium nipponense[J]. Jiangsu Journal of Agricultural Sciences, 2007, 23(6): 612-617. [谢国驷, 蔡永祥, 徐维娜, 等. 饲料蛋白水平对日本沼虾生长、消化酶和免疫酶的影响[J]. 江苏农业学报, 2007, 23(6): 612-617.] |
| [36] |
Zhang L Y, Ye J Y, Wang Y H, et al. Effects of dietary protein levels on growth of oriental river prawn Macrobrachium nipponense[J]. Journal of Shanghai Fisheries University, 2008, 17(6): 668-673. [张凌燕, 叶金云, 王友慧, 等. 配合饲料中不同蛋白质水平对日本沼虾生长的影响[J]. 上海水产大学学报, 2008, 17(6): 668-673.] |
| [37] |
Liu G F, Xu P, Wu T, et al. Present condition of aquaculture nitrogen and phosphorus environmental pollution and future development strategy[J]. Jiangsu Journal of Agricultural Sciences, 2018, 34(1): 225-233. [刘国锋, 徐跑, 吴霆, 等. 中国水产养殖环境氮磷污染现状及未来发展思路[J]. 江苏农业学报, 2018, 34(1): 225-233.] |
| [38] |
Qin C J, Shao T, Zhao D X, et al. Effect of ammonia-N and pathogen challenge on complement component 8α and 8β expression in the darkbarbel catfish Pelteobagrus vachellii[J]. Fish & Shellfish Immunology, 2017, 62: 107-115. DOI:10.1016/j.aqrep.2017.08.001 |
| [39] |
Guo H, Xian J A, Wang A L, et al. Effects of nitrite stress on haemocyte toxicity and p53 gene expression of Litopenaeus vannamei[J]. Journal of Hydroecology, 2015, 36(2): 61-67. [郭慧, 冼健安, 王安利, 等. 亚硝酸盐对凡纳滨对虾血细胞毒性及p53基因表达的影响[J]. 水生态学杂志, 2015, 36(2): 61-67.] |
| [40] |
Li Z H, Ma H K, Zhang P, et al. Effects of density stress on the growth of Exopalaemon carinicauda and the ammonia nitrogen content in aquaculture water during culturing[J]. Marine Fisheries, 2018, 40(5): 581-586. [李志辉, 马杭柯, 张培, 等. 不同养殖密度对脊尾白虾生长和水体氨氮含量的影响[J]. 海洋渔业, 2018, 40(5): 581-586.] |
 2020, Vol. 27
2020, Vol. 27

